Moderna (вакцина)
Moderna (вакцина)
| |
| Систематизована назва за IUPAC | |
| Класифікація | |
| ATC-код | Немає |
| PubChem | |
| CAS | |
| DrugBank | DB15654 |
| Тип | mRNA |
| Способи введення | Внутрішньом'язова ін'єкція |
| Хімічна структура | |
| Формула | |
| Мол. маса | |
| Синоніми | mRNA-1273, CX-024414, COVID-19 mRNA Vaccine Moderna, TAK-919, Moderna COVID‑19 Vaccine, COVID‑19 Vaccine Moderna, COVID-19 Vaccine Moderna Intramuscular Injection,[1] |
| Фармакокінетика | |
| Біодоступність | |
| Метаболізм | |
| Період напіввиведення | |
| Екскреція | |
| Реєстрація лікарського засобу в Україні | |
Вакцина Moderna проти COVID‑19 (МНН: elasomeran[2]), кодова назва mRNA-1273 і продається під торговою маркою Spikevax,[3][4] - вакцина проти COVID-19, розроблена компанією Moderna, американськими Національним інститутом алергії та інфекційних захворювань[en] (NIAID), Управлінням з удосконалення біомедичних досліджень[en] (BARDA). Вона дозволена для використання для людей у віці 12 років і старше в деяких країнах, а також людям віком від 18 років в інших країнах для забезпечення захисту від коронавірусної хвороби 2019, яку спричиняє вірус SARS-CoV-2.[5][3] Вводиться внутрішньом'язовими ін'єкціями у вигляді курсу з двох доз по 0,5 мл; другу дозу вводять через 29 днів після першої.[6]
Це РНК-вакцина, що складається з модифікованої нуклеозидами матричної рибонуклеїнової кислоти[en] (модРНК), що кодує пепломер SARS-CoV-2, який інкапсульований у наночастинках ліпідів[en].[7]
Вакцина Moderna проти COVID-19 дозволена для використання на певному рівні в 53 країнах, включаючи Канаду, країни Європейської економічної зони, Сінгапур, Філіппіни, Південну Корею, Таїланд, Велику Британію та США.[8]
15 березня 2021 року розпочалася І фаза клінічних випробувань другої вакцини Moderna проти COVID-19 (mRNA-1283).[9][10]
Медичне застосування
Вакцина Moderna проти COVID-19 використовується для захисту від зараження вірусом SARS-CoV-2 з метою запобігання коронавірусній хворобі 2019.[5][3]
Вакцина вводиться внутрішньом'язово в дельтоподібний м'яз.[11] Початковий курс складається з двох доз.[11] Всесвітня організація охорони здоров'я (ВООЗ) рекомендує інтервал між ін'єкціями 28 днів.[12] Дані демонструють, що ефективність першої дози зберігається до десяти тижнів.[12] Тому, щоб уникнути смертей, коли запаси обмежені, ВООЗ рекомендує відкласти другу дозу на 12 тижнів для досягнення високого охоплення першої дози у пріоритетних групах.[12]
Ефективність
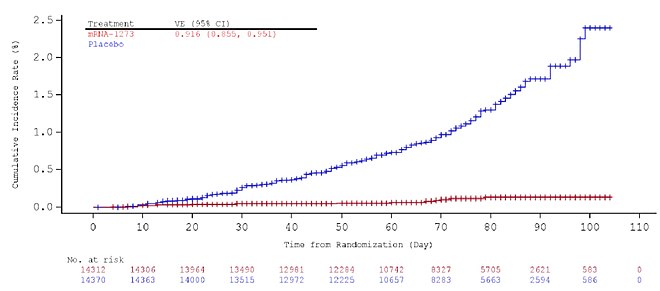
Докази ефективності вакцини з'являються приблизно через два тижні після першої дози.[13] Висока ефективність досягається при проведенні повної імунізації через два тижні після прийому другої дози, і її оцінюють у 94,1%: наприкінці дослідження вакцини, яке стало підставою до надання дозволу на екстренне використання в США, у групі вакцинованих було діагностовано одинадцять випадків COVID-19 (з 15 181 людини) проти 185 випадків у групі плацебо (15 170 осіб).[13] Більше того, у групі вакцинованих було зареєстровано нуль випадків важкого перебігу COVID-19 порівняно з одинадцятьма у групі плацебо.[14] Ця ефективність була описана як "приголомшлива"[15] та "гранично історична"[16] для вакцини проти респіраторних вірусів, і вона подібна до ефективності вакцини Pfizer-BioNTech проти COVID-19.[17][18]
Оцінки ефективності були подібними для вікових груп, статей, расових та етнічних груп, а також учасників із супутніми захворюваннями, пов’язаними з високим ризиком тяжкого перебігу COVID-19.[19] Досліджувались лише особи віком від 18 років. Тривають дослідження щодо оцінки ефективності та безпеки у дітей віком від 0 до 11 років (KidCOVE) та 12-17 років (TeenCOVE).[20]
Подальше дослідження, проведене Центрами з контролю та профілактики захворювань у США (CDC) у період з грудня 2020 року до березня 2021 року, серед майже 4 тисяч медичних працівників, осіб, які надають першу допомогу, та інших важливих та пов'язаних з інфекцією працівників, дійшли висновку, що в реальних умовах ефективність повної імунізації за допомогою мРНК-вакцинації (14 днів або більше після другої дози) становила 90% проти інфекцій SARS-CoV-2, незалежно від симптомів, а ефективність вакцини від часткової імунізації (14 днів або більше після першої дози, але до другої дози) становила 80%.[21]
Станом на квітень 2021 року тривалість захисту від вакцини невідома,[7][22] і для визначення тривалості захисту триває подальше дворічне дослідження.[16]
Дієвість
| Варіант | Дві дози | Одна доза | ||
|---|---|---|---|---|
| Симптоматика | Госпіталізація | Симптоматика | Госпіталізація | |
| Інші циркулюючі раніше | 93% (87–96%) | 90% (80–100%) | 61% (53–67%) | 76% (46–90%) |
| Альфа | 90% (85–94%) | 94% (59–99%) | 61% (56–66%) | 59% (39–73%) |
| Бета | 88% (61–96%) | 100%[c] | 43% (22–59%) | 56% (−9 to 82%) |
| Гамма[en] | ||||
| Дельта | Не повідомляється | Не повідомляється | Не повідомляється | Не повідомляється |
Конкретні групи населення
Наявні обмежені дані щодо безпеки вакцини Moderna проти COVID-19 для вагітних.[25] Початкове дослідження виключило вагітних жінок або було припинено їхню вакцинацію після позитивного тесту на вагітність.[13] Дослідження на тваринах не виявили проблем з безпекою, і зараз проводяться клінічні випробування щодо оцінки безпеки та ефективності вакцин проти COVID-19 у вагітних.[25] Реальні спостереження за допомогою програми відстеження CDC v-safe не виявили незвичайної кількості несприятливих випадків або результатів, що становлять інтерес.[26] На підставі результатів попереднього дослідження, Центри з контролю та профілактики захворювань у США рекомендували вагітним вакцинуватися вакциною проти COVID-19.[27][28]
Побічні ефекти

Всесвітня організація охорони здоров'я (ВООЗ) заявила, що "дані безпеки підтверджують сприятливий профіль безпеки" і що профіль побічних реакцій[en] вакцини "не передбачає жодних особливих проблем безпеки".[13] Найбільш поширеними побічними реакціями були біль у місці ін’єкції, втома, головний біль, міалгія (біль у м’язах) та артралгія (біль у суглобах).[13]
Центри з контролю та профілактики захворювань у США (CDC) повідомляли про анафілаксію (важку алергічну реакцію) у 2,5 випадків на мільйон введених доз і рекомендували 15-хвилинний період спостереження після ін’єкції.[30] Уповільнені шкірні реакції в місцях ін’єкцій, що спричиняють еритему, подібну до висипу, також спостерігалися в рідкісних випадках, але вони не вважаються серйозними чи протипоказаннями для подальшої вакцинації.[31] Частота локальної несприятливої еритеми становить близько 10,8%, у 1,9% випадків почервоніння може поширюватися до розміру 100 мм або більше.[32]
23 червня 2021 року Центри з контролю та профілактики захворювань у США підтвердили, що міокардит або перикардит зустрічається приблизно у 13 з 1 мільйона молодих людей, переважно чоловіків і старше 16 років, які отримали вакцину Moderna або Pfizer-BioNTech. Більшість постраждалих швидко одужують при адекватному лікуванні та відпочинку.[33]
Фармакологія
Технологія Moderna використовує сполуку з модифікованої нуклеозидами матричної рибонуклеїнової кислоти[en] (модРНК) під кодовою назвою mRNA-1273. Як тільки сполука потрапляє всередину клітини людини, мРНК зв’язується з ендоплазматичним ретикулумом клітини. mRNA-1273 кодується, щоб викликати у клітин вироблення специфічного білка, використовуючи звичайний процес виробництва клітини. Вакцина кодує версію спайкового білка з модифікацією під назвою 2P, в якій білок включає дві стабілізуючі мутації, в яких вихідні амінокислоти замінені пролінами, розробленими дослідниками з Техаського університету в Остіні та Центру досліджень вакцини Дейла та Бетті Бамперс[en] Національного інституту алергії та інфекційних захворювань[en].[34][35][36][37]
Після того, як білок витісняється з клітини, він з часом виявляється імунною системою, яка починає виробляти ефективні антитіла. Система доставки лікарських засобів mRNA-1273 використовує систему ПЕГілювання ліпосомної доставки наночастинок[en] (LNP).[38]
Склад
Вакцина містить такі інгредієнти:[5][39]
Активний інгредієнт - це послідовність мРНК, що містить загалом 4101 нуклеотидів, що кодує повнорозмірний глікопротеїн пепломеру SARS-CoV-2 (S)[40] з двома мутаціями (K986P та V987P), призначеними для стабілізації конформації перед злиттям.
Послідовність мРНК додатково оптимізується такими інгридієнтами:[41][42]
- усі уридини (U), заміщені N1-метилпсевдоуридином[en] (U → m1Ψ),
- оболонка із штучної 5 'нетрансльованої області (UTR) та 3' UTR, отриманої з гена альфа-глобіну людини (HBA1),
- впровадження двох додаткових стоп-кодонів,
- кінцевий 3 'полі(А) хвіст.
Передбачувана послідовність мРНК-вакцини була опублікована на форумі для професійних вірусологів, отримана шляхом прямого секвенування залишкового матеріалу вакцини у використаних флаконах.[43]
мРНК вакцини розчиняють у водному буфері, що містить трометамін, гідрохлорид[en] трометаміну, натрій ацетат та сахарозу.[11] мРНК інкапсульована в наночастинках ліпідів[en], які стабілізують мРНК і полегшують її надходження в клітини.[7] Наночастинки виробляються з таких ліпідів:
- 1,2-дистеароїл-сн-гліцеро-3-фосфохолін[en] (DSPC),[11]
- холестерол,[11]
- PEG2000-DMG[en] (поліетиленгліколь (PEG) 2000-диміристоїлгліцерин (DMG)),[11] та
- SM-102[11]
Виробництво
У червні 2020 року Moderna уклала контракт з Catalent[en], відповідно до якого Catalent наповнюватиме та пакуватиме флакони із кандидатом на вакцину. Catalent також забезпечить зберігання та розповсюдження.[44]
9 липня 2020 року Moderna повідомила про угоду про незавершене виробництво з Laboratorios Farmacéuticos Rovi у разі схвалення вакцини.[45]
Moderna значною мірою покладається на організації контрактного виробництва[en], для розширення процесу виробництва вакцин. Першим кроком процесу - синтезом ДНК-плазмід (який буде використовуватися як шаблон для синтезу мРНК) - займався підрядник під назвою Aldevron із Фарго, штат Північна Дакота, США.[46] Для решти процесу Moderna уклала договір з компанією Lonza Group[en] щодо виробництва вакцини на підприємствах у Портсмуті, штат Нью-Гемпшир, США та у Фісп у Швейцарії, та закупівлі необхідних допоміжних речовин ліпідів у компанії CordenPharma.[47] Крім організацій контрактного виробництва, Moderna також виробляє вакцину на власному виробничому підприємстві в Норвуді, штат Массачусетс, США.[48]
Для виконання завдань з наповнення та упаковки флаконів (заповнення та завершення[en]) Moderna уклала контракти з Catalent[en] у США та Laboratorios Farmacéuticos Rovi в Іспанії.[47] У квітні 2021 року Moderna розширила угоду з Catalent щодо збільшення обсягів виробництва на заводі останньої в Блумінгтоні, штат Індіана, США. Розширення дозволить Catalent виробляти до 400 флаконів на хвилину та заповнювати ще 80 мільйонів флаконів на рік.[49] Пізніше цього ж місяця, Moderna оголосила про свої плани витратити мільярди доларів на збільшення виробництва вакцин, потенційно потроївши обсяги виробництва у 2022 році, стверджуючи також, що в 2021 році вона виробить не менше 800 мільйонів доз. Збільшення виробництва частково пояснюється удосконаленням компанією методів виробництва.[50][51][52]
Результати дослідження вакцини, розробленої Moderna, послідували за попередніми результатами дослідження кандидата на вакцину Pfizer-BioNTech BNT162b2, причому Moderna демонструє подібну ефективність, але вимагає зберігання при температурі стандартного медичного холодильника 2–8 °C до 30 днів або -20 °C протягом чотирьох місяців, тоді як кандидат Pfizer-BioNTech вимагає зберігання в ультрахолодних морозильних камерах[en] при температурі між -80 і -60 °C.[53][54] Країни з низьким рівнем доходу зазвичай мають холодові ланцюги для зберігання лише у стандартних холодильниках, а не в ультрахолодних морозильних камерах.[55][56] У лютому 2021 року обмеження щодо вакцини Pfizer були послаблені, коли Управління з продовольства і медикаментів США (FDA) оновило дозвіл на екстрене використання (EUA), щоб дозволити транспортувати та зберігати нерозбавлені заморожені флакони вакцини при температурі між -25 та -15 °C протягом двох тижнів перед використанням.[39][57][58]
У листопаді 2020 року Nature повідомив, що "Хоча відмінності у складах LNP або вторинних структурах мРНК можуть пояснювати відмінності в термостабільності [між Moderna та BioNtech], багато експертів підозрюють, що обидва вакцинні продукти в кінцевому підсумку зупиняться на однакових вимогах щодо зберігання при різних температурних умовах та термінів зберігання".[59]
Історія
У січні 2020 року Moderna оголосила про розробку РНК-вакцини, під назвою mRNA-1273, для індукування імунітету до SARS-CoV-2.[60][61][62]
Moderna отримала 955 мільйонів доларів від Управління з удосконалення біомедичних досліджень США, офісу Міністерства охорони здоров'я і соціальних служб США. Управління з удосконалення біомедичних досліджень США профінансувало 100% вартості отримання ліцензії від Управління з продовольства і медикаментів США.[63][64]
Уряд Сполучених Штатів виділив 2,5 мільярда доларів США загального фінансування на вакцину Moderna проти COVID-19 (mRNA-1273).[65] Приватні донори також внесли внесок у розробку вакцини.[66]
Клінічні випробування
Фаза I–II
У квітні 2020 року у партнерстві з Національним інститутом алергії та інфекційних захворювань США[en] розпочалася I фаза клінічних випробування на людях вакцини mRNA-1273.[67] У квітні Управлінням з удосконалення біомедичних досліджень США[en] (BARDA) виділило до 483 мільйонів доларів на розробку вакцини Moderna.[68] Плани щодо випробування дозування та ефективності під час II фази клінічних виробувань, яке розпочнеться у травні, були схвалені Управліннямз продовольства і медикаментів США (FDA).[69] Moderna уклала угоду про партнерство зі швейцарським виробником вакцин Lonza Group[en],[70] з метою постачання 300 мільйонів доз вакцини на рік.[71]
25 травня 2020 року Moderna розпочала фазу IIa клінічного дослідження, до якої було залучено 600 дорослих учасників для оцінки безпеки та відмінностей у відповіді антитіл на дві дози кандидата на вакцину mRNA-1273, яке планується завершити в 2021 році.[72]
14 липня 2020 року вчені Moderna опублікували попередні результати I фази клінічного випробування підвищення дози mRNA-1273, що демонструє дозозалежну індукцію нейтралізуючих антитіл проти S1/S2 вже через 15 днів після ін'єкції. Помірний та небажаний вплив[en], такий як гарячка, втома, головний біль, міалгія та біль у місці ін'єкції, спостерігались у всіх групах дозування, але часто спостерігались при збільшенні дозування.[42] Вакцина в низьких дозах була визнана безпечною та ефективною для допуску до III фази клінічного випробування із застосуванням двох доз по 100 мкг, які вводяться з інтервалом 29 днів.[42]
У липні 2020 року Moderna повідомила у попередньому звіті в рамках державно-приватного партнерства Operation Warp Speed[en], що кандидат на викцину призвів до вироблення організмом нейтралізуючих антитіл[en] у здорових дорослих на І фазі клінічного дослідження.[42][73] «При дозуванні у 100 мікрограмів, яку „Moderna“ просуває до більш масштабних досліджень, усі 15 пацієнтів відчували побічні ефекти, включаючи втому, озноб, головний біль, біль у м'язах та біль у місці ін'єкції».[74] Проблемні збільшені дози були виключені в липні з майбутніх досліджень.[74]
Фаза III
Moderna та Національний інститут алергії та інфекційних захворювань[en] 27 липня розпочали III фазу клінічних досліджень в США, плануючи зарахувати та розподілити 30 000 добровольців до двох груп — одна група отримувала дві дози вакцини mRNA-1273 по 100 мкг, а інша отримувала плацебо 0,9 % хлориду натрію.[75] Станом на 7 серпня зареєструвалось понад 4 500 добровольців.
У вересні 2020 року Moderna опублікувала детальний план вивчення результатів клінічного дослідження.[76] 30 вересня генеральний директор Стефан Бансель заявив, що, якщо дослідження будуть успішними, вакцина може бути доступна для суспільства вже наприкінці березня або на початку квітня 2021 року.[77] Станом на жовтень 2020 року Moderna завершила реєстрацію 30 000 учасників, необхідних для проведення III фази клінічних досліджень.[78] Національний інститут охорони здоров'я США оголосив 15 листопада 2020 року, що загальні результати досліджень були позитивними.[79]
Станом на лютий 2021 року, проміжний аналіз III фази клінічного дослідження вказує на ефективність на рівні 94% у запобіганні зараженню COVID-19.[7][54][80] Побічні ефекти включали грипоподібні симптоми, такі як біль у місці ін'єкції, втома, біль у м'язах та головний біль.[54] Клінічне випробування триває і має завершитися наприкінці 2022 року.[81]
Із вересня 2020 року компанія Moderna використовує тест Elecsys Anti-SARS-CoV-2 S компанії Roche Diagnostics[en], схвалений Управлінням з продовольства і медикаментів США (FDA) згідно з дозволом на екстрене використання (EUA) 25 листопада 2020 року. За словами незалежного постачальника клінічних аналізів у мікробіології, «це полегшить кількісне вимірювання антитіл до SARS-CoV-2 та допоможе встановити кореляцію між індукованим захистом вакцини та рівнем антитіл до рецепторів зв'язування (RBD)». Про партнерство Roche повідомила 9 грудня 2020 року.[82]
Огляд Управління з продовольства і медикаментів США у грудні 2020 року проміжних результатів клінічних випробувань III фази mRNA-1273 показав, що вакцина є безпечною та ефективною проти інфекції COVID-19, що стало підставою до видачі дозволу на екстрене використання у США.[83]
Ліцензування
Прискорене
Станом на грудень 2020 року mRNA-1273 перебувала на етапі оцінки для отримання дозволу на екстрене використання[en] (EUA) у багатьох країнах, що дозволило б швидко розповсюдити вакцину у Великій Британії, Європейському Союзі, Канаді та США.[84][85][86][87]
18 грудня 2020 року mRNA-1273 була дозволена Управлінням з продовольства і медикаментів США (FDA) для екстреного використання.[88][89][83] This is the first product from Moderna that has been authorized by the FDA.[90][91]
23 грудня 2020 року mRNA-1273 була дозволена Департаментом здоров'я Канади[en].[92][93]
5 січня 2021 року Міністерство здоров’я[en] дозволило використовувати mRNA-1273 в Ізраїлі.[94]
3 лютого 2021 року Управління медичних наук[en] дозволив використання mRNA-1273 у Сінгапурі.[95]
30 квітня 2021 року Всесвітня організація охорони здоров'я (ВООЗ) затвердила список екстрених випадків для використання вакцини Moderna.[96][97]
5 травня 2021 року Управління з продовольства і медикаментів Філіппін[en] дозволила mRNA-1273 для екстреного використання на Філіппінах.[98]
21 травня 2021 року внутрішньом'язову вакцину Moderna проти COVID-19 (раніше TAK-919) було дозволено для екстреного використання в Японії.[1]
29 червня 2021 року Генеральний контролер з наркотиків Індії[en] дозволив використання mRNA-1273 в Індії.[99] Того ж дня вакцина також була схвалена Міністерством охорони здоров’я В’єтнаму[en] для екстреного застосування в країні.[100]
5 серпня 2021 року Національне агентство з регулювання фармацевтичної діяльності Малайзії (NPRA) надало умовну реєстрацію для екстреного використання вакцини в країні.[101]
Звичайне
6 січня 2021 року Європейське агентство з лікарських засобів (EMA) рекомендувало надати умовний дозвіл на продаж,[3][102] і рекомендація була прийнята Європейською комісією того ж дня.[4][103] 6 червня 2021 року EMA розпочала оцінку заявки на розширене застосування вакцини Moderna проти COVID-19 для людей віком від 12 до 17 років.[104]
12 січня 2021 року Швейцарське агентство з лікувальних товарів[en] видало тимчасовий дозвіл на мРНК-вакцину Moderna у Швейцарії.[105][106]
1 квітня 2021 року Агентство з регулювання лікарських засобів та медичних товарів[en] видало повний дозвіл на продаж вакцини у Сполученому Королівстві.[107]
Подальші дослідження
Залишається невідомим, чи вакцина Moderna проти COVID-19 забезпечує довічний імунітет, чи потрібні періодичні ревакцинації.[54] Вагітні та жінки, що годують груддю, також були виключені з перших випробувань, які використовувалися для отримання дозволу на екстрене використання,[108] хоча очікується, що випробування у цих групах населення будуть проведені у 2021 році.[109]
У січні 2021 року Moderna оголосила, що запропонує третю дозу вакцини людям, які були щеплені двічі на етапі I фази клінічних досліджень. Додаткова доза буде доступна учасникам через шість-дванадцять місяців після того, як вони отримали другу дозу. Компанія заявила, що може також вивчити третю ін'єкцію в учасників III фази випробування, для підтвердження даних про стійкість антитіл.[110][111][112]
У 2020 році Moderna співпрацювала з фармацевтичною компанією Takeda Pharmaceutical Company[en] та Міністерством охорони здоров’я, праці й добробуту Японії (MHLW).[113][114] У Японії вакцина відома як "Внутрішньом'язова вакцина Moderna проти COVID-19" (англ. COVID-19 Vaccine Moderna Intramuscular Injection).[115][1]
25 січня 2021 року Moderna розпочала розробку нової форми вакцини, яка отримала назву mRNA-1273.351, яка могла б бути використана як додаткова ін'єкція проти бета-варіанту SARS-CoV-2 (лінія поколінь В.1.351).[116][117] Вона також розпочала тестування, щоб побачити, чи можна використати третю ін'єкцію існуючої вакцини для протидії різним варіантам вірусу.[117] 24 лютого Moderna оголосила, що виготовила та відправила достатню кількість mRNA-1273.351 до Національного інституту охорони здоров'я США для проведення І фази клінічних випробувань.[118] 16 березня 2021 року, щоб збільшити кількість вакцинованих, Moderna розпочала клінічні випробування вакцини для дітей віком від 6 місяців до 11 років у США та Канаді (KidCove),[119] на додаток до існуючого та повність хваленого дослідження вакцини для дітей віком 12-17 років (TeenCOVE).[120][121]
Moderna випробовує дослідницькі додаткові ін'єкції mRNA-1273.351 та mRNA-1273.211.[121][122][123]
Суспільство та культура
Торгові марки
mRNA-1273 була кодовою назвою під час розробки та тестування,[7][91] elasomeran - запропонована міжнародна непатентована назва (pINN),[2][41] а Spikevax - торгова марка.[3]
Економіка
У червні 2020 року Сінгапур підписав угоду про попередню закупівлю з компанією Moderna, за якою, як повідомляється, країна сплачує високу ціну, щоб забезпечити достроковий запас вакцини, хоча уряд відмовився надавати фактичну ціну та кількість, посилаючись на комерційну чутливість та положення про конфіденційність.[124][125]
11 серпня 2020 року уряд США уклав угоду про закупівлю 100 мільйонів доз очікуваної вакцини Moderna,[126] яку, як пише Financial Times, Moderna планувала оцінити від 50 до 60 доларів США за курс вакцинації.[127] У листопаді 2020 року Moderna заявила, що буде стягувати з урядів, які купують її вакцину, від 25 до 37 доларів США за дозу, тоді як ЄС шукає вакцину ціною менше 25 доларів США за дозу за 160 мільйонів доз, які вона планує придбати у Moderna.[128][129]
У 2020 році Moderna також уклала угоди про постачання mRNA-1273 з Європейським Союзом на 160 мільйонів доз та з Канадою на 56 мільйонів доз.[130][131] 17 грудня у твіті державного секретаря з питань бюджету Бельгії[en] було сказано, що ЄС заплатить 18 доларів США за дозу, тоді як Нью-Йорк таймс повідомив, що США заплатять 15 доларів США за дозу.[132]
Зважаючи на схвалення вакцини 23 грудня 2020 року у Канаді, прем'єр-міністр Канади Джастін Трюдо раніше заявив, що поставки почнуться протягом 48 годин після схвалення, а до кінця грудня буде поставлено 168 000 доз.[133]
17 лютого 2021 року перша партія прибула до Сінгапуру.[134]
У лютому 2021 року Moderna заявила, що очікує на продаж вакцини проти COVID-19 на 18,4 млрд доларів.[135]
Суперечки
7 липня сталі відомо про суперечки між Moderna та державними вченими щодо небажання компанії ділитися даними клінічних досліджень.[136]
Moderna також зіткнулася з критикою за те, що їй не вдалося залучити кольорових людей до клінічних випробувань.[137]
Патентна тяганина
Система ПЕГілювання ліпосомної доставки наночастинок[en] (LNP) mRNA-1273 була предметом постійного судового спору з Arbutus Biopharma[en], від якого Moderna раніше хотіла отримала ліцензію на технологію LNP.[38][138] 4 вересня 2020 року Nature Biotechnology повідомив, що Moderna програла ключовий спір у цій справі.[139]
Участь в COVAX
Бере участь в COVAX — глобальна ініціатива, спрямована на рівний доступ до вакцин проти COVID-19.
В Україні
Україна отримала 2 000 040 доз вакцини Moderna проти COVID-19 від уряду США через глобальну ініціативу COVAX[140][141].
Див. також
- Комірнаті, вакцина Pfizer/BioNTech
- AZD1222, вакцина AstraZeneca
Виноски
- ↑ 14 грудня 2020 року - 19 квітня 2021 року в Онтаріо, Канада.[23]
- ↑ Вакцина зазвичай вважається ефективною, якщо її оцінка становить ≥50% з нижньою межею >30% з довірчим інтервалом 95%.[24]
- ↑ Довірчий інтервал не надано, тому неможливо дізнатися точність цього вимірювання.
Примітки
- ↑ а б в Takeda (21 травня 2021). "Takeda Announces Approval of Moderna's COVID-19 Vaccine in Japan". Прес-реліз. (англ.)
- ↑ а б (24 червня 2021). "TGA grants provisional determination for the Moderna COVID-19 vaccine, Elasomeran". Прес-реліз. (англ.)
- ↑ а б в г д Spikevax (previously COVID-19 Vaccine Moderna) EPAR. Європейське агентство з лікарських засобів (EMA). 4 січня 2021. Процитовано 29 червня 2021. (англ.)
- ↑ а б "European Commission authorises second safe and effective vaccine against COVID-19". Прес-реліз. (англ.)
- ↑ а б в Moderna COVID-19 Vaccine- cx-024414 injection, suspension. DailyMed. Процитовано 20 грудня 2020. (англ.)
- ↑ Moderna COVID-19 Vaccine. Dosing & Administration. Американське товариство інфекційних хвороб[en]. 4 січня 2021. Процитовано 5 січня 2021. (англ.)
- ↑ а б в г д Л.Р. Баден, Х.М. Ель-Салі, Б. Ессінк, К. Котлофф, С. Фрей, Р. Новак, Д. Дімерт, С. А. Спектор, Н. Руфаель, C.B. Крич, Дж. Макґеттіган, С. Хетан, Н. Сегалла, Дж. Соліс, А. Брос, К. Фієрро, Г. Шварц, К. Нойзіл, Л. Корі, П. Гілберт, Г. Джейнс, Д. Фоллманн, М. Марович, Дж. Маскола, Л. Полаковський, Дж. Леджервуд, Б.С. Грем, Г. Беннетт, Р. Пажон, Ч. Найтлі, Б. Лів, В. Денг, Г. Чжоу, С. Хан, М. Іварссон, Дж. Міллер, Т. Закс (Лютий 2021). Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. The New England Journal of Medicine 384 (5): 403–416. PMC 7787219. PMID 33378609. doi:10.1056/NEJMoa2035389. (англ.)
- ↑ COVID-19 Vaccine Tracker: Moderna: mRNA-1273. Університет Макгілла. (англ.)
- ↑ Moderna (15 березня 2021). "First Participants Dosed in Phase 1 Study Evaluating mRNA-1283, Moderna's Next Generation COVID-19 Vaccine". Прес-реліз. (англ.)
- ↑ Moderna begins testing next-generation coronavirus vaccine. Рейтер. 15 березня 2021. Процитовано 15 червня 2021. (англ.)
- ↑ а б в г д е ж Moderna COVID-19 Vaccine Standing Orders for Administering Vaccine to Persons 18 Years of Age and Older. Центри з контролю та профілактики захворювань у США (CDC). (англ.)
- ↑ а б в Всесвітня організація охорони здоров'я (ВООЗ) (Червень 2021). Interim recommendations for use of the Moderna mRNA-1273 vaccine against COVID-19 (Guidance). WHO/2019-nCoV/vaccines/SAGE_recommendation/mRNA-1273/2021.2. (англ.)
- ↑ а б в г д Background document on the mRNA-1273 vaccine (Moderna) against COVID-19. Всесвітня організація охорони здоров'я (ВООЗ). Лютий 2021. WHO/2019-nCoV/vaccines/SAGE_recommendation/mRNA-1273/background/2021.1. (англ.)
- ↑ Vaccines and Related Biological Products Advisory Committee Meeting. Управління з продовольства і медикаментів США. 17 грудня 2020. (англ.)
- ↑ Г. Брансвелл (2 лютого 2021). Comparing the Covid-19 vaccines developed by Pfizer, Moderna, and Johnson & Johnson. Процитовано 28 березня 2021. (англ.)
- ↑ а б Moderna Vaccine Shows Significant COVID-19 Prevention Efficacy in Phase 3 Data. (англ.)
- ↑ С.К. Мішра, Т. Трипаті (Лютий 2021). One year update on the COVID-19 pandemic: Where are we now?. Acta Tropica 214: 105778. PMC 7695590. PMID 33253656. doi:10.1016/j.actatropica.2020.105778. (англ.)
- ↑ С.А.Мео, І.А. Бухарі, Дж. Акрам, А.С. Мео, Д.С. Клонофф (Лютий 2021). COVID-19 vaccines: comparison of biological, pharmacological characteristics and adverse effects of Pfizer/BioNTech and Moderna Vaccines. European Review for Medical and Pharmacological Sciences 25 (3): 1663–1669. PMID 33629336. doi:10.26355/eurrev_202102_24877. (англ.)
- ↑ VRBPAC mRNA-1273 Sponsor Briefing Document (PDF). Moderna. 17 грудня 2020. (англ.)
- ↑ Дж. Дженко (16 березня 2021). Moderna testing COVID-19 vaccine in children under 12. AAP News. (англ.)
- ↑ М.Г. Томпсон, Дж. Л. Берджесс, А. Л. Налівей, Г. Л. Тайнер, С. К. Юн, Дж. Міс, Л. Ольшо, А.Й. Кабан-Мартінес, А. Фоулкс, К. Лутрік, Дж. Л. Кунц, К. Данніган, М. Дж. Одеан, К. Т. Гегманн, Е. Стефанський, Л. Дж. Едвардс, Н. Шефер-Солле, Л. Грант, К. Еллінгсон, Г.Сі. Грум, Т. Зуніє, М.С. Тіз, Л. Івачич, М.Г. Веслі, Дж. М. Ламберт, X. Сун, М. Е. Сміт, А. Л. Філіпс, К. Д. Грувер, Ю.М. Ю, Дж. Джеральд, Р.Т. Браун, М.К. Геррінг, Г. Джозеф, С. Бейтель, Т. Морілл, Дж. Мак, П. Ріверс, К.М. Гарріс, Д.Р. Гант, М. Арвай, П. Кутті, А.М. Фрай, М. Гаглані (Квітень 2021). Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers - Eight U.S. Locations, December 2020-March 2021. MMWR. Morbidity and Mortality Weekly Report 70 (13): 495–500. PMC 8022879. PMID 33793460. doi:10.15585/mmwr.mm7013e3.
 Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
- ↑ Н. Дорія-Роуз, М.С. Сутар, М. Маковскі, С. О'Коннел, А.Б. Макдермотт, Б. Флеч, Дж.І. Ледгервуд, Дж.Р. Маскола, Б.С. Грем, Б.К. Лін, С. О'Делл, С.Д. Шмідт, А.Т. Відж, В.В. Едара, Е.Дж. Андерсон, Л. Лай, К. Флойд, Н. Руфаель, В. Зарніцина, П. Робертс, М. Макхене, В. Бюкенен, С. Дж. Люк, Дж. Бейгель, Л.А.Джексон, К.М. Неузіл, Г. Беннетт, Б Лів, Дж. Алберт, П.Кунвар (Червень 2021). Antibody Persistence through 6 Months after the Second Dose of mRNA-1273 Vaccine for Covid-19. N Engl J Med 384 (23): 2259–2261. PMID 33822494. doi:10.1056/NEJMc2103916. (англ.)
- ↑ Г. Чунг, С. Гі, С. Насрін, M.І. Сандарам, С.A. Бучан, С.І. Вілсон, Б. Чен, А. Кальзавара, Д. Б. Філл, П.К. Остін, К. Вільсон (28 травня 2021). Effectiveness of BNT162b2 and mRNA-1273 COVID-19 vaccines against symptomatic SARS-CoV-2 infection and severe COVID-19 outcomes in Ontario, Canada. medRxiv[en] (Препринт). eTables 5 and 6. doi:10.1101/2021.05.24.21257744. (англ.)
- ↑ П. Краузе, Т.Р. Флемінг, І. Лонгіні, А.М. Генао-Рестрепо, Р. Пето (Вересень 2020). COVID-19 vaccine trials should seek worthwhile efficacy. Lancet 396 (10253): 741–743. PMC 7832749. PMID 32861315. doi:10.1016/S0140-6736(20)31821-3. «WHO recommends that successful vaccines should show an estimated risk reduction of at least one-half, with sufficient precision to conclude that the true vaccine efficacy is greater than 30%. This means that the 95% CI for the trial result should exclude efficacy less than 30%. Current US Food and Drug Administration guidance includes this lower limit of 30% as a criterion for vaccine licensure.» (англ.)
- ↑ а б Vaccination Considerations for People Pregnant or Breastfeeding. Центри з контролю та профілактики захворювань у США (CDC). 18 березня 2021. Процитовано 24 квітня 2021. (англ.)
- ↑ Т. Шимабукуро (1 березня 2021). COVID-19 Vaccine Safety Update. (англ.)
- ↑ К. Сміт (24 квітня 2021). New CDC guidance recommends pregnant people get the COVID-19 vaccine. CBS News. Процитовано 24 квітня 2021. (англ.)
- ↑ Т.Т.Шимабукуро, С.Й. Кім, Т.Р. Майерс, П.Л. Моро, Т. Одуєбо, Л. Панагіотакопулос, П. Маркес, К. Олсон, Р. Лю, К.Т. Чанг, С.Р. Еллінгтон, В.К. Буркель, А. Смоутс, К. Джей Грін, Ч. Ліката, Б. Чжан, М. Алімчандані, А. Мба-Джонас, С. Мартін, Дж. М. Гі, Д. М. Міні-Делман (Червень 2021). Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons. The New England Journal of Medicine 384 (24): 2273–2282. PMC 8117969. PMID 33882218. doi:10.1056/NEJMoa2104983. (англ.)
- ↑ Е. Вайзе (7 квітня 2021). COVID-19 toes, Moderna arm, all-body rash: Vaccines can cause skin reactions but aren't dangerous, study says. Ю-Ес-Ей тудей. (англ.)
- ↑ CDC COVID-19 Response Team (Січень 2021). Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Moderna COVID-19 Vaccine - United States, December 21, 2020-January 10, 2021. MMWR. Morbidity and Mortality Weekly Report 70 (4): 125–129. PMC 7842812. PMID 33507892. doi:10.15585/mmwr.mm7004e1.
 Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
- ↑ К. Г. Блюменталь, Е. Е. Фрімен, Р. Р. Сафф, Л. Б. Робінзон, А.Р. Вольфсон, Р.К. Форман, Д. Гашимото, А. Банерджі, Л. Лі, С. Анварі, Е.С. Шеной (Квітень 2021). Delayed Large Local Reactions to mRNA-1273 Vaccine against SARS-CoV-2. The New England Journal of Medicine 384 (13): 1273–1277. PMC 7944952. PMID 33657292. doi:10.1056/NEJMc2102131. (англ.)
- ↑ FACT SHEET FOR HEALTHCARE PROVIDERS ADMINISTERING VACCINE (VACCINATION PROVIDERS) EMERGENCY USE AUTHORIZATION (EUA) OF THE MODERNA COVID-19 VACCINE TO PREVENT CORONAVIRUS DISEASE 2019 (COVID-19). FDA. Процитовано 5 серпня 2021. (англ.)
- ↑ National Center for Immunization and Respiratory Diseases (23 червня 2021). Myocarditis and Pericarditis Following mRNA COVID-19 Vaccination. CDC.gov. Центри з контролю та профілактики захворювань у США. Процитовано 2 липня 2021. (англ.)
- ↑ Р. Кросс (29 вересня 2020). The tiny tweak behind COVID-19 vaccines. Chemical & Engineering News 98 (38). Процитовано 30 вересня 2020. (англ.)
- ↑ К. Й. Джонсон (6 грудня 2020). A gamble pays off in 'spectacular success': How the leading coronavirus vaccines made it to the finish line. The Washington Post. Процитовано 9 грудня 2020. (англ.)
- ↑ Дж. Крамер (31 грудня 2020). They spent 12 years solving a puzzle. It yielded the first COVID-19 vaccines.. National Geographic. (англ.)
- ↑ К.С. Корбетт, Д. Едвардс, С.Р. Лейст, О.М. Абіона, С. Бойоглу-Барнум, Р. Гіллеспі, С. Гімансу, А. Шефер, К.Т. Зіваво, А.Т. Діпіаца, К.Г. Діннон, С.М. Ельбашир, C.A. Шов, А. Вудс, Е. Дж. Фрітч, Д.Р. Мартінес, К.В. Бок, М. Мінай, Б.М. Нагата, Г.Б. Гатчінсон, К. Бал, Д. Гарсія-Домінгес, Л. Ма, І. Ренці, В.П. Конг, С.Д. Шмідт, Л. Ван, Ю. Чжан, Л. Дж. Стівенс, Е. Пхунг, Л. А. Чанг, Р. Дж. Ломіс, Н.Є. Альтарас, Е. Нараянан, М. Меткар, В. Пресняк, Ч. Лю, М.К. Лаудер, В. Ши, К. Леунг, Е.С. Янг, А. Вест, К.Л. Гуллі, Н. Ванг, Д. Врапп, Н. А. Дорія-Роуз, Г. Стюарт-Джонс, Г. Беннетт, М. Насон, Т. Раквардт, Дж. МакЛеллан, М.Р.Денісон, Дж.Д.Чаппелл, І.Н. Мур, К.М. Морабіто, Дж. Р. Маскола, Р.С. Баріч, А. Карфі, Б.С. Грам (Червень 2020). SARS-CoV-2 mRNA Vaccine Development Enabled by Prototype Pathogen Preparedness. bioRxiv. PMC 7301911. PMID 32577634. doi:10.1038/s41586-020-2622-0. (англ.)
- ↑ а б Дороті Р. Аут; Майкл Б. Павелл (14 вересня 2020). Patent Issues Highlight Risks of Moderna's COVID-19 Vaccine. New York Law Journal[en]. Процитовано 1 грудня 2020. (англ.)
- ↑ а б Fact Sheet for Healthcare Providers Administering Vaccine (PDF). Управління з продовольства і медикаментів США. Грудень 2020. Процитовано 31 грудня 2020. (англ.)
- ↑ GenBank ID MN908947.3. National Center for Biotechnology Information (NCBI), U.S. National Library of Medicine. (англ.)
- ↑ а б ((Всесвітня організація охорони здоров'я)) (Червень 2021). INN Proposed International Nonproprietary Names: List 125 COVID-19 (special edition). WHO Drug Information 35 (2): 578-9. (англ.)
- ↑ а б в г Джексон Л.А., Андерсон Е.Дж., Руфаель Н.Г., Робертс П.К., Махене М., Колер Р.Н., Маккалло М.П., Чаппелл Дж.Д., Денісон М.Р., Стівенс Л.Дж., Пруйссерс A.Дж., Макдермотт А., Флеч Б., Дорія-Роуз Н.А., Корбетт К.С., Морабіто К.М., О'Делл С., Шмідт С.Д., Свонсон П.А., Паділла М., Маскола Дж.Р., НойзІл К.М., Беннет Г., Сан В., Пітерс Е., Маковські М., Альберт Дж., Кросс К., Бьюкенен В., Пікаарт-Таутжес Р., Леджервуд Дж.Е., Грем Б.С., Бейгель Дж.Г. (Листопад 2020). An mRNA Vaccine against SARS-CoV-2 - Preliminary Report. The New England Journal of Medicine 383 (20): 1920–1931. PMC 7377258. PMID 32663912. doi:10.1056/NEJMoa2022483. (англ.)
- ↑ Д. Е. Чонг, М. Маккой, К. Артилес, О. Ільбай, А. Файер, К. Надо, Г. Парк, Б. Беттс, С. Бойд, Р. Го, М. Шоура (23 березня 2021). Assemblies of putative SARS-CoV2-spike-encoding mRNA sequences for vaccines BNT-162b2 and mRNA-1273. Virological.org. (англ.)
- ↑ Moderna eyes third quarter for first doses of potential COVID-19 vaccine with Catalent deal. Рейтер. 25 червня 2020. Архів оригіналу за 16 листопада 2020. Процитовано 6 листопада 2020. (англ.)
- ↑ Дж. Лі. Moderna signs on for another COVID-19 vaccine manufacturing deal. MarketWatch. Архів оригіналу за 16 листопада 2020. Процитовано 9 липня 2020. (англ.)
- ↑ П. Спрінгер (24 травня 2021). Fargo firm makes key ingredient for millions of COVID-19 vaccine doses. Grand Forks Herald. (англ.)
- ↑ а б Р. Маллін (25 листопада 2020). Pfizer, Moderna ready vaccine manufacturing networks. Chemical & Engineering News (American Chemical Society). Процитовано 21 грудня 2020. (англ.)
- ↑ Дж. Коте (4 травня 2021). Moderna to more than double size of Massachusetts facility, transform production and lab space to industrial tech center. MassLive. (англ.)
- ↑ Дж. С. Гопкінс (6 квітня 2021). Moderna Covid-19 Vaccine Production Pace to Increase at Contract Manufacturer Catalent. Волл-стріт джорнел. Процитовано 13 квітня 2021. (англ.)
- ↑ П. Лофтус (21 березня 2021). Covid-19 Vaccine Manufacturing in U.S. Races Ahead. Волл-стріт джорнел. Процитовано 29 квітня 2021. (англ.)
- ↑ Дж. Вільямс (29 квітня 2021). Moderna doubling COVID-19 vaccine production. The Hill[en]. Процитовано 29 квітня 2021. (англ.)
- ↑ П. Лофтус (29 квітня 2021). Moderna to Boost Covid-19 Vaccine Production to Meet Rising Global Demand. Волл-стріт джорнел. Процитовано 29 квітня 2021. (англ.)
- ↑ Pfizer-BioNTech COVID-19 Vaccine Vaccination Storage & Dry Ice Safety Handling. Pfizer. Процитовано 17 грудня 2020. (англ.)
- ↑ а б в г Б. Лавлейс-молодший, Н. Гіггінс-Данн (16 листопада 2020). Moderna says preliminary trial data shows its coronavirus vaccine is more than 94% effective, shares soar. CNBC. Процитовано 17 листопада 2020. (англ.)
- ↑ Г. Макгрегор (5 грудня 2020). How China's COVID-19 could fill the gaps left by Pfizer, Moderna, AstraZeneca. Fortune. Архів оригіналу за 12 грудня 2020. Процитовано 5 грудня 2020. (англ.)
- ↑ Pfizer's Vaccine Is Out of the Question as Indonesia Lacks Refrigerators: State Pharma Boss. Jakarta Globe. 22 листопада 2020. Архів оригіналу за 7 грудня 2020. Процитовано 5 грудня 2020. (англ.)
- ↑ (25 лютого 2021). "Coronavirus (COVID-19) Update: FDA Allows More Flexible Storage, Transportation Conditions for Pfizer-BioNTech COVID-19 Vaccine". Прес-реліз.
 Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
- ↑ (19 лютого 2021). "Pfizer and BioNTech Submit COVID-19 Vaccine Stability Data at Standard Freezer Temperature to the U.S. FDA". Прес-реліз. (англ.)
- ↑ Є. Долгін (Листопада 2020). COVID-19 vaccines poised for launch, but impact on pandemic unclear. Nature Biotechnology. PMID 33239758. doi:10.1038/d41587-020-00022-y. (англ.)
- ↑ Й. Стінхайсен, К. Келланд (24 січня 2020). With Wuhan virus genetic code in hand, scientists begin work on a vaccine. Рейтер. Архів оригіналу за 25 січня 2020. Процитовано 26 січня 2020. (англ.)
- ↑ К. Кері (26 лютого 2020). Increasing number of biopharma drugs target COVID-19 as virus spreads. BioWorld. Архів оригіналу за 27 лютого 2020. Процитовано 1 березня 2020. (англ.)
- ↑ Г. Еверетт (27 лютого 2020). These 5 drug developers have jumped this week on hopes they can provide a coronavirus treatment. Markets Insider. Архів оригіналу за 16 листопада 2020. Процитовано 1 березня 2020. (англ.)
- ↑ Moderna Announces Expansion of BARDA Agreement to Support Larger Phase 3 Program for Vaccine (mRNA-1273) Against COVID-19. Moderna. Процитовано 25 квітня 2021. (англ.)
- ↑ А. Клоус (24 листопада 2020). Fact check: Moderna vaccine funded by government spending, with notable private donation. Ю-Ес-Ей тудей. Процитовано 25 квітня 2021. (англ.)
- ↑ Д. Грейді (16 листопада 2020). Early Data Show Moderna's Coronavirus Vaccine Is 94.5% Effective. Нью-Йорк таймс. Процитовано 25 квітня 2021. (англ.)
- ↑ Т. Белла (18 листопада 2020). Dolly Parton helped fund Moderna's vaccine. It began with a car crash and an unlikely friendship.. The Washington Post. Процитовано 25 квітня 2021. (англ.)
- ↑ NIH clinical trial of investigational vaccine for COVID-19 begins. Національний інститут охорони здоров'я США (NIH). 16 березня 2020. Архів оригіналу за 19 березня 2020. Процитовано 18 березня 2020. (англ.)
- ↑ Р. Кузня, К. Полглазе, Г. Мецофіоре (1 травня 2020). In quest for vaccine, US makes 'big bet' on company with unproven technology. CNN. Архів оригіналу за 13 травня 2020. Процитовано 2 травня 2020. (англ.)
- ↑ А. Кеовн (7 травня 2020). Moderna moves into Phase II testing of COVID-19 vaccine candidate. BioSpace. Архів оригіналу за 16 листопада 2020. Процитовано 9 травня 2020. (англ.)
- ↑ К. Бланкеншип (1 травня 2020). Moderna aims for a billion COVID-19 shots a year with Lonza manufacturing tie-up. FiercePharma. Архів оригіналу за 16 листопада 2020. (англ.)
- ↑ Swiss factory rushes to prepare for Moderna Covid-19 vaccine. SWI swissinfo.ch. 7 жовтня 2020. Архів оригіналу за 16 листопада 2020. Процитовано 7 жовтня 2020. (англ.)
- ↑ Номер клінічного дослідження NCT04405076 для "Dose-Confirmation Study to Evaluate the Safety, Reactogenicity, and Immunogenicity of mRNA-1273 COVID-19 Vaccine in Adults Aged 18 Years and Older" на вебсайті ClinicalTrials.gov (англ.)
- ↑ Ю. Лі (14 липня 2020). Dow futures jump more than 200 points after Moderna says its vaccine produces antibodies to coronavirus. CNBC. Архів оригіналу за 16 листопада 2020. Процитовано 15 липня 2020. (англ.)
- ↑ а б М. Герпер, Д. Гард (14 липня 2020). First data for Moderna Covid-19 vaccine show it spurs an immune response. Stat[en] (Boston Globe Media). Архів оригіналу за 14 липня 2020. Процитовано 15 липня 2020. (англ.)
- ↑ Дж. Палка (27 липня 2020). COVID-19 vaccine candidate heads to widespread testing in U.S.. NPR. Архів оригіналу за 11 жовтня 2020. Процитовано 27 липня 2020. (англ.)
- ↑ Н. Пальяруло, ред. (17 вересня 2020). Moderna, in bid for transparency, discloses detailed plan of coronavirus vaccine trial. BioPharma Dive. Архів оригіналу за 16 листопада 2020. Процитовано 18 вересня 2020. (англ.)
- ↑ Л. Маскаренхас (1 жовтня 2020). Moderna chief says Covid-19 vaccine could be widely available by late March. CNN. Архів оригіналу за 16 листопада 2020. Процитовано 2 жовтня 2020. (англ.)
- ↑ Е. Коен. First large-scale US Covid-19 vaccine trial reaches target of 30,000 participants. CNN. Архів оригіналу за 16 листопада 2020. Процитовано 23 жовтня 2020. (англ.)
- ↑ Promising Interim Results from Clinical Trial of NIH-Moderna COVID-19 Vaccine. Національний інститут охорони здоров'я США (NIH). 15 листопада 2020. (англ.)
- ↑ C. Циммер (20 листопада 2020). 2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works.. Нью-Йорк таймс. Процитовано 21 листопада 2020. (англ.)
- ↑ Номер клінічного дослідження NCT04470427 для "A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19" на вебсайті ClinicalTrials.gov (англ.)
- ↑ Moderna Use Roche Antibody Test During Vaccine Trials. rapidmicrobiology.com. 10 грудня 2020. Процитовано 13 грудня 2020. (англ.)
- ↑ а б Statement from NIH and BARDA on the FDA Emergency Use Authorization of the Moderna COVID-19 Vaccine. Національний інститут охорони здоров'я США. 18 грудня 2020. (англ.)
- ↑ Е. Коен (30 листопада 2020). Moderna applies for FDA authorization for its Covid-19 vaccine. CNN. Процитовано 4 грудня 2020. (англ.)
- ↑ Л. Бургер (1 грудня 2020). COVID-19 vaccine sprint as Pfizer-BioNTech, Moderna seek emergency EU approval. Рейтер. Процитовано 4 грудня 2020. (англ.)
- ↑ Г. Кухлер (30 листопада 2020). Canada could be among the first to clear Moderna's COVID-19 vaccine for use. The Financial Post. Процитовано 4 грудня 2020. (англ.)
- ↑ Л. Парсонс (28 жовтня 2020). UK's MHRA starts rolling review of Moderna's COVID-19 vaccine. PharmaTimes. Процитовано 4 грудня 2020. (англ.)
- ↑ "FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine". Прес-реліз. (англ.)
- ↑ Moderna COVID-19 Vaccine Emergency Use Authorization (PDF). Управління з продовольства і медикаментів США. 18 грудня 2020. Процитовано 20 грудня 2020.
 Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
- ↑ Дж. Лі. Moderna nears its first-ever FDA authorization, for its COVID-19 vaccine. MarketWatch. Процитовано 19 грудня 2020. (англ.)
- ↑ а б С.E. Олівер, Дж. Гаргано, М. Марін, М. Воллес, К.Г. Карран, M. Чемберленд, Н. Маккланг, Д. Кампос-Ауткалт, Р.Л. Морган, С. Мбаеї, Дж.Р. Ромеро, H.K. Талбот, Г.М. Лі, Б.П. Белл, К. Дулінг (Січень 2021). The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine - United States, December 2020. MMWR. Morbidity and Mortality Weekly Report 69 (5152): 1653–1656. PMID 33382675. doi:10.15585/mmwr.mm695152e1.
 Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
Ця стаття містить текст із цього джерела, який знаходиться у суспільному надбанні. (англ.)
- ↑ Regulatory Decision Summary – Moderna COVID-19 Vaccine. Департамент здоров'я Канади[en]. 23 грудня 2020. Процитовано 23 грудня 2020. (англ.)
- ↑ Moderna COVID-19 Vaccine (mRNA-1273 SARS-CoV-2). COVID-19 vaccines and treatments portal. 23 грудня 2020. Процитовано 23 грудня 2020. (англ.)
- ↑ Israel authorises use of Moderna's COVID-19 vaccine. Yahoo! News. Процитовано 5 січня 2021. (англ.)
- ↑ Singapore becomes first in Asia to approve Moderna's COVID-19 vaccine. Рейтер. 3 лютого 2021. Процитовано 3 лютого 2021. (англ.)
- ↑ (30 квітня 2021). "WHO lists Moderna vaccine for emergency use". Прес-реліз. (англ.)
- ↑ WHO lists anti-COVID Moderna vaccine for emergency use. Philippine Daily Inquirer. Agence France-Presse. 1 травня 2021. (англ.)
- ↑ В. Лопес (5 травня 2021). Philippines grants EUA to Moderna's COVID-19 vaccine. GMA News Online. Процитовано 5 травня 2021. (англ.)
- ↑ Р. Каул (29 червня 2021). Moderna's Covid vaccine approved for use in India. Hindustan Times (en). (англ.)
- ↑ Л. Нга (29 червня 2021). Vietnam approves Moderna Covid vaccine for emergency use. VnExpress. Архів оригіналу за 1 липня 2021. Процитовано 1 липня 2021. (англ.)
- ↑ NPRA Approves Moderna Covid-19 Vaccine. CodeBlue. 5 серпня 2021. Архів оригіналу за 7 серпня 2021. Процитовано 8 серпня 2021. (англ.)
- ↑ Європейське агентство з лікарських засобів (6 січня 2021). "EMA recommends COVID-19 Vaccine Moderna for authorisation in the EU". Прес-реліз. (англ.)
- ↑ COVID-19 Vaccine Moderna. Europa[en]. (англ.)
- ↑ (8 червня 2021). "EMA evaluating the use of COVID-19 Vaccine Moderna in young people aged 12 to 17". Прес-реліз. (англ.)
- ↑ Дж. Міллер (12 січня 2021). Swiss drugs regulator approves Moderna's COVID-19 vaccine. Рейтер. Процитовано 17 січня 2021. (англ.)
- ↑ (12 січня 2020). "Swissmedic grants authorisation for the COVID-19 vaccine from Moderna". Прес-реліз. (англ.)
- ↑ Regulatory approval of COVID-19 Vaccine Moderna. gov.uk. 1 квітня 2021. (англ.)
- ↑ С. Лутра (23 листопада 2020). Pregnant women haven't been included in promising COVID-19 vaccine trials. (англ.)
- ↑ К.Крубінер, Р.Р.Фейден, Р.А. Каррон (9 грудня 2020). FDA: Leave the door open to Covid-19 vaccination for pregnant and lactating health workers. STAT. (англ.)
- ↑ Г. Макдоннелл Нієто дель Ріо (15 січня 2021). Covid-19: Over Two Million Around the World Have Died From the Virus. Нью-Йорк таймс. Процитовано 18 січня 2021. (англ.)
- ↑ М. Тіррел (14 January 2021). Moderna looks to test Covid-19 booster shots a year after initial vaccination. CNBC. Процитовано 18 січня 2021. (англ.)
- ↑ Moderna Explores Whether Third Covid-19 Vaccine Dose Adds Extra Protection. Волл-стріт джорнел. Процитовано 18 січня 2021. (англ.)
- ↑ Japan's Takeda to import 50 million doses of Moderna's COVID-19 vaccine, raises profit forecast. Рейтер. 29 жовтня 2020. Процитовано 2 липня 2021. (англ.)
- ↑ Takeda to supply Japan with Moderna's COVID-19 vaccine. European Pharmaceutical Review. 2 листопада 2020. (англ.)
- ↑ Takeda (21 січня 2021). "Start of a Japanese Clinical Study of TAK-919, Moderna's COVID-19 Vaccine Candidate". Прес-реліз. (англ.)
- ↑ Moderna COVID-19 Vaccine Update (PDF). 25 січня 2021. (англ.)
- ↑ а б Д. Грейді, А. Мандавіллі, К. Томас (25 січня 2021). Is the Covid-19 Vaccine Effective Against New South African Variant?. Нью-Йорк таймс. Процитовано 25 січня 2021. (англ.)
- ↑ (24 лютого 2021). "Moderna Announces it has Shipped Variant-Specific Vaccine Candidate, mRNA-1273.351, to NIH for Clinical Study". Прес-реліз. (англ.)
- ↑ П. Лофтус (16 березня 2021). Moderna Is Testing Its Covid-19 Vaccine on Young Children. Волл-стріт джорнел. Процитовано 16 березня 2021. (англ.)
- ↑ Moderna testing COVID-19 vaccine in children under 12. American Academy of Pediatrics. 16 березня 2021. (англ.)
- ↑ а б (5 серпня 2021). "Moderna Reports Second Quarter Fiscal Year 2021 Financial Results and Provides Business Updates". Прес-реліз.
- ↑ Safety and Immunogenicity Study of a SARS-CoV-2 (COVID-19) Variant Vaccine (mRNA-1273.351) in Naïve and Previously Vaccinated Adults. ClinicalTrials.gov. 5 березня 2021. Процитовано 5 серпня 2021.
- ↑ A Study to Evaluate the Immunogenicity and Safety of mRNA-1273.211 Vaccine for COVID-19 Variants. ClinicalTrials.gov. 15 червня 2021. Процитовано 5 серпня 2021.
- ↑ Securing Singapore's access to COVID-19 vaccines. www.gov.sg. Уряд Сінгапуру. 14 грудня 2020. Процитовано 1 лютого 2021.
- ↑ С. Халік (1 лютого 2021). How Singapore picked its Covid-19 vaccines. The Straits Times. Процитовано 1 лютого 2021.
- ↑ Trump says U.S. inks agreement with Moderna for 100 mln doses of COVID-19 vaccine candidate. Yahoo. Рейтер. 11 серпня 2020. Архів оригіналу за 16 листопада 2020. Процитовано 12 серпня 2020.
- ↑ Moderna aims to price coronavirus vaccine at $50–$60 per course: FT. Рейтер. 28 липня 2020. Процитовано 20 березня 2021.
- ↑ Donald Trump appears to admit Covid is 'running wild' in the US. Ґардіан. 22 листопада 2020. Процитовано 22 листопада 2020. «Moderna told the Germany [sic] weekly Welt am Sonntag that it will charge governments between $25 and $37 per dose of its Covid vaccine candidate, depending on the amount ordered.»
- ↑ Ф. Гуарасьо (24 листопада 2020). EU secures 160 million doses of Moderna's COVID-19 vaccine. Рейтер. Процитовано 25 листопада 2020.
- ↑ Coronavirus: Commission approves contract with Moderna to ensure access to a potential vaccine. Європейська комісія. 25 листопада 2020. Процитовано 4 грудня 2020.
- ↑ New agreements to secure additional vaccine candidates for COVID-19. Офіс прем'єр-міністра, уряд Канади. 25 вересня 2020. Процитовано 4 грудня 2020.
- ↑ М. Стівіс-Гріднефф, М. Зангер-Кац, Н. Вейланд (18 грудня 2020). A European Official Reveals a Secret: The U.S. Is Paying More for Coronavirus Vaccines. Нью-Йорк таймс. Процитовано 19 грудня 2020.
- ↑ І. Остін (23 грудня 2020). Canada approves the Moderna vaccine, paving the way for inoculations in its vast Far North. Нью-Йорк таймс. Процитовано 24 грудня 2020.
- ↑ First shipment of Moderna's COVID-19 vaccine arrives in Singapore. CNA. Процитовано 17 лютого 2021.
- ↑ М. Маддіпатла, М. Мішра (25 лютого 2021). Moderna sees $18.4 billion in sales from COVID-19 vaccine in 2021. Рейтер. Процитовано 25 лютого 2021.
- ↑ Маріса Тейлор; Робін Респаут (7 липня 2020). Exclusive: Moderna spars with U.S. scientists over COVID-19 vaccine trials. Рейтер. Архів оригіналу за 16 листопада 2020. Процитовано 10 липня 2020. (англ.)
- ↑ Moderna vaccine trial contractors fail to enroll enough people of color, prompting slowdown. NBC News. Рейтер. 6 жовтня 2020. Процитовано 17 листопада 2020.
- ↑ Натан Варді (29 червня 2020). Moderna's Mysterious Coronavirus Vaccine Delivery System. Forbes. Процитовано 1 грудня 2020. (англ.)
- ↑ Moderna loses key patent challenge. Nature Biotechnology 38 (9): 1009. Вересень 2020. PMID 32887970. doi:10.1038/s41587-020-0674-1. (англ.)
- ↑ В Україну привезли 2 млн доз вакцини Moderna. Кого нею щепитимуть. bbc.com (uk). BBC. 8 липня 2021. Процитовано 21 липня 2021.
- ↑ США надали Україні два мільйони доз вакцини Moderna. ukrinform.ua/ (uk). Укрінформ. 17 липня 2021. Процитовано 21 липня 2021.
Посилання
- VRBPAC mRNA-1273 Sponsor Briefing Document (PDF). Moderna. 17 грудня 2020.
- How Moderna's Covid-19 Vaccine Works. Нью-Йорк таймс.
| ||||||||||||||||||||||||||||||||||||||||||
Інформація
Стаття Moderna (вакцина) в українській Вікіпедії посіла такі місця в місцевому рейтингу популярності:
Про сторінку
Представлений вміст статті Вікіпедії було вилучено в 2021-08-23 на основі https://uk.wikipedia.org/?curid=4093811