Фавипиравир
| Фавипиравир | |
|---|---|
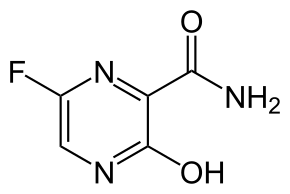 | |
| Химическое соединение | |
| ИЮПАК | 6-фторо-3-гидроксипиразин-2-карбоксамид |
| Брутто-формула | C5H4FN3O2 |
| Молярная масса | 157,104 г/моль |
| CAS | 259793-96-9 |
| PubChem | 492405 |
| DrugBank | 12466 |
| Состав | |
| Классификация | |
| АТХ | J05AX27 |
| Способы введения | |
| перорально | |
| Другие названия | |
| Фавилавир, Авифавир, Авиган, Арепливир, Коронавир, T-705 | |
Фавипирави́р — противовирусный препарат, разработанный в Японии для лечения гриппа[1]. Обладает широким спектром активности против РНК-содержащих вирусов, включая вирусы гриппа, риновирус, респираторно-синцитиальный вирус, а также опасные для жизни вирусы. Не работает против ДНК-содержащих вирусов, в числе которых аденовирус, вирус простого герпеса первого типа и цитомегаловирус. Принцип действия основан на ингибировании вирусной РНК-зависимой РНК-полимеразы путём терминирования удлинения формирующейся цепи РНК[2], но касательно механизма действия есть и другие мнения.
Препарат показал активность против многих вирусов в лабораторных условиях in vitro и эффективность в испытаниях на животных. На людях испытывался против опасных для жизни вирусов лихорадок Эбола и Ласса, вирусов бешенства и тяжелой лихорадки с синдромом тромбоцитопении. Пока отсутствуют штаммы, выработавшие устойчивость к препарату[2].
До получения международного названия фавипиравир обозначался индексом разработчика T-705[2]. Первые публикации о препарате появились в 2002 году[3].
На начало 2020 года у фавипиравира есть регистрация в Японии и Франции[4], в мае 2020 года он получил временную регистрацию в России[5][6].
Применение в медицине
Фавипиравир был одобрен для лечения гриппа в Японии[7]. Однако он показан только для нового гриппа (штаммы, вызывающие более тяжелые заболевания), а не для сезонного гриппа[7]. По состоянию на 2020 год вероятность развития резистентности представляется низкой[7].
Побочные эффекты
Фавипиравир является относительно безопасным препаратом. Однако исследования показали, что он может приводить к дозозависимому повышению уровня мочевой кислоты в крови — гиперурикемии. Пока что нет никаких доказательств возможных клинических проявлений вызванной фавипиравиром гиперурикемии, хотя при более длительном курсе лечения они не исключаются. Также есть предположения о возможном увеличении интервала QT под действием фавипиравира, однако для подтверждения или опровержения этого требуются дополнительные исследования[8].
Имеющиеся доказательства предполагают безопасность и хорошую переносимость препарата при краткосрочных курсах лечения, однако безопасность фавипиравира при длительном использовании не изучена, требуются дальнейшие исследования[8].
Однако приём фавипиравира во время беременности может нанести вред будущему ребёнку[9][10]. Эксперименты на 4 видах животных показали замедленное развитие эмбриона и его смерть в первом триместре, однако исследования на людях, включающие беременных или кормящих женщин, отсутствуют. В связи с риском тератогенности Японское бюро по безопасности лекарственных средств (англ. Pharmaceuticals and Medical Devices Agency) ввело строгие ограничения для использования препарата среди женщин репродуктивного возраста и предписало производителю указывать предупреждение об этом на упаковках и в инструкциях. Фавипиравир разрешено использовать в Японии только при отсутствии альтернатив[8][11].
Механизм действия
О механизме действия фавипиравира есть разные мнения. Одни исследователи считают, что фавипиравир селективно ингибирует вирусную РНК-зависимую РНК-полимеразу[12]. Другие исследования показывают, что фавипиравир индуцирует летальные мутации РНК-трансверсии, производя нежизнеспособный вирусный фенотип[13].
Также есть мнение, что фавипиравир как в пероральной, так и внутривенной формах является пролекарством, которое метаболизируется до его активной формы, фавипиравир-рибофуранозил-5'-трифосфат (фавипиравир-RTP)[14][15]. Считается, что человеческая гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT) играет ключевую роль в процессе его активации[16].
История
Изначально в разработавшей препарат компании Toyama Chemical надеялись, что фавипиравир станет новым лекарством от гриппа, которое может заменить осельтамивир, но эксперименты на животных показали, что он может негативно влиять на ДНК будущего ребёнка с риском повреждения плода, поэтому одобрение данного препарата Министерством здравоохранения, труда и социального обеспечения Японии было отложено на неопределённый срок[17].
В 2014 году фавипиравир был одобрен в Японии в качестве препарата против гриппа[18] — ограниченно разрешён для лечения гриппа A и B, вызванного резистентными к противовирусным препаратам штаммами[19], и не предназначен для лечения сезонного гриппа. По состоянию на 2020 год вероятность развития резистентности вируса гриппа к препарату остаётся низкой[9].
15 марта 2020 года препарат был разрешён к продаже в Китае для лечения гриппа[20]. 30 мая 2020 года фавипиравир, выпускаемый под торговым наименованием «Авифавир» на совместном предприятии «ХимРара» и РФПИ, зарегистрирован в России как лекарство от коронавирусной инфекции[21]. До 17 сентября 2020 года[22] фавипиравир в России не был предназначен для продажи в розницу, а разрешен к применению только в условиях стационара[5]. Немецкое правительство также закупило некоторое количество фавипиравира, чтобы поставлять его в клиники по запросам врачей, но спросом у них он не пользуется. Немецкие специалисты отмечают, что в России, относительно европейских стран, ниже требования к клиническим исследованиям, необходимым для сертификации (регистрации) лекарств, а сама процедура регистрации менее строгая, чем у них[5].
Фавипиравир изучался как потенциальное средство для лечения коронавирусной инфекции COVID-19[1]. Он не оправдал ожиданий: в исследовании, выполненном по стандартам доказательной медицины, завершённом в середине 2020 года, значимый терапевтический эффект у него не обнаружен[23][24].Фавипиравир изучается как потенциальное средство для лечения ряда других вирусных инфекций[1].
В России
29 мая 2020 года первый препарат фавипиравира зарегистрирован Минздравом РФ[25]. С июня-июля 2020 года фавипиравир доступен в России под торговыми марками «Авифавир», «Арепливир» и «Коронавир»[25][26].
Общество и культура
Правовой статус
Министерство обороны США разработало фавипиравир в партнерстве с MediVector, Inc. в качестве противовирусного препарата широкого спектра действия и спонсировало его в рамках клинических испытаний фазы II и III FDA, в которых он продемонстрировал безопасность для людей и эффективность против вируса гриппа[27]. Несмотря на демонстрацию безопасности более чем у 2000 пациентов и ускорение выведения вируса гриппа на 6–14 часов в неопубликованных исследованиях фазы III, фавипиравир по-прежнему не одобрен в Великобритании и США[28]. В 2014 году Япония одобрила фавипиравир для лечения штаммов гриппа, не реагирующих на современные противовирусные препараты[29]. Первоначально компания Toyama Chemical надеялась, что фавипиравир станет новым лекарством от гриппа, которое сможет заменить осельтамивир (торговая марка Тамифлю). Однако эксперименты на животных показывают потенциал тератогенных эффектов, и одобрение производства Министерством здравоохранения, труда и социального обеспечения было сильно задержано, а условия производства ограничены только в случае чрезвычайной ситуации в Японии[30].
Фирменные наименования
Фавипиравир продается под торговыми марками Avigan (ア ビ ガ ン, Abigan), Avifavir, Areplivir, FabiFlu[31] и Favipira[32].
Исследования
Стиль этого раздела неэнциклопедичен или нарушает нормы русского языка. |
COVID-19
Несколько клинических испытаний фавипиравира уже проведены или продолжаются[33].
Согласно результатам исследования, завершившегося в Японии, значимый эффект применения фавипиравира не обнаружен[23][24].
В феврале 2020 года фавипиравир изучается в Китае для экспериментального лечения возникшего COVID-19[34][35]. Планируются также испытания в Японии[36].
Исследование с участием 80 человек по сравнению с лопинавиром/ритонавиром показало, что он снижает время выведения вируса и что 91% людей улучшили результаты компьютерной томографии с небольшим количеством побочных эффектов. Ограничением этого исследования было то, что оно не было рандомизированным, двойным слепым и плацебо-контролируемым[37][38].
Препарат одобрен для использования в клинических испытаниях коронавирусной болезни 2019 года в Китае[39]. Из-за COVID-19 фавипиравир был быстро одобрен для продажи в феврале 2020 года в Китае. Данные клинических испытаний фавипиравира против COVID-19 были опубликованы Министерством науки и технологий Китайской Народной Республики на тематической пресс-конференции по COVID-19 17 марта, согласно которой фавипиравир показал хорошую клиническую эффективность против этого заболевания. . А форма таблеток также делает его легкодоступным, что помогает снизить нагрузку на медицинские ресурсы, позволяя пациентам в некритическом состоянии принимать лекарство дома. После того, как фавипиравир был запущен на китайский рынок, он был внесен в список основных антипандемических материалов Государственным советом Китая, и правительство Китая объединило распределение поставок фавипиравира. После вспышки COVID-19, помимо удовлетворения внутреннего спроса на лечение и стратегических резервов, это лекарство также использовалось для поддержки более 30 стран в борьбе с COVID-19 и добилось хороших результатов. Все таблетки Фавипиравира в Китае производятся компанией Zhejiang Hisun Pharmaceutical Co., Ltd., которая недавно была удостоена Государственного совета Китая звания «Фабрика боеприпасов» в ответ на кризис COVID-19. В марте 2020 года Италия одобрила препарат для экспериментального использования против COVID-19 и начала проводить испытания в трех регионах, наиболее пострадавших от этого заболевания[40]. Однако итальянское фармацевтическое агентство напомнило общественности, что имеющиеся доказательства в поддержку этого препарата являются скудными и предварительными[41]. По состоянию на 20 апреля 2020 года планируется изучить его в трех больницах Массачусетса, США[42]. По состоянию на начало мая 2020 года исследование начинается в Лондоне, Великобритания[43].
Препарат был одобрен для лечения COVID-19 в больницах в России 29 мая 2020 года после того, как в продолжающемся открытом рандомизированном клиническом исследовании приняли участие 60 пациентов, принимавших фавипиравир[44]. Согласно государственному регистру клинических испытаний, ожидается, что в этом исследовании COVID-FPR-01 будет набрано 390 субъектов, и оно завершится к 31 декабря 2020 года[45]. 30 мая 2020 года Минздрав России утвердил генерическую версию фавипиравира под названием Авифавир. Российский фонд прямых инвестиций (РФПИ) поддержал разработку Авифавира и нашел его высокоэффективным на первом этапе клинических испытаний[46][47][48]. 25 июня 2020 года Минздрав России одобрил еще один препарат на основе фавипиравира. Испытание с участием 50 пациентов в Бангладеш привело к 96% выздоровлению в тяжелых случаях через 10 дней по сравнению с 52% в контрольной группе[49].
15 марта 2020 года препарат был одобрен в Китае для лечения COVID-19[39]. 20 июня 2020 года препарат был одобрен в Индии для лечения пациентов с COVID-19 под торговой маркой Fabiflu производства Glenmark.
Эбола
Исследования, проведенные в 2014 году, показали, что фавипиравир может иметь эффективность против лихорадки Эбола, основываясь на исследованиях на мышах; эффективность у людей не рассматривалась[50][51][52].
Сообщается, что во время вспышки вируса Эбола в Западной Африке в 2014 году французская медсестра, которая заразилась вирусом Эбола, работая волонтером в организации «Врачи без границ» (MSF) в Либерии, выздоровела после курса фавипиравира[53]. Клинические испытания по изучению использования фавипиравира против болезни, вызванной вирусом Эбола, начались в Гекеду, Гвинея, в декабре 2014 года[54]. Предварительные результаты, представленные в 2016 году на Конференции по ретровирусам и оппортунистическим инфекциям (CROI), опубликованные позднее, показали снижение смертности у пациентов уровень вируса в крови от низкого до среднего, но не влияет на пациентов с высоким уровнем (группа с более высоким риском смерти)[55][56]. Дизайн испытания одновременно подвергался критике за использование только исторического контроля[57].
Вирус Нипах
Вирус Нипах, оболочечный РНК-вирус, связанный с лихорадкой, связанной с энцефалитом, и вспышками острого респираторного дистресса с высокой смертностью. Первая вспышка произошла в Малайзии-Сингапуре, связанная с контактом со свиньями на бойнях, и вспышка на Филиппинах, связанная с убоем лошадей, большинство других вспышек затронуло Индию и Бангладеш. в Бангладеш вспышки часто связаны с потреблением сырого сока финиковой пальмы, загрязненного слюной и мочой летучих мышей[58]. В исследовании, опубликованном в Scientific Reports, использовалась модель сирийского хомяка для заражения вирусом Нипах, которая точно отражает большинство аспектов болезней человека, таких как широко распространенный васкулит, пневмония и энцефалит. Хомяков инфицировали летальной дозой 104 БОЕ NiV-M внутрибрюшинным путем, аналогичным предыдущим исследованиям, и лечение начинали сразу после заражения. Фавипиравир вводили два раза в день пероральным путем в течение 14 дней. Обработанные хомяки показали 100% выживаемость и отсутствие очевидной заболеваемости после смертельного заражения NiV, тогда как все контрольные случаи умерли от тяжелой болезни[59].
Другие исследования
В экспериментах на животных фавипиравир показал активность против вируса Западного Нила, вируса желтой лихорадки, вируса ящура, а также других флавивирусов, аренавирусов, буньявирусов и альфавирусов[60]. Также была продемонстрирована активность против энтеровирусов[61] и вируса лихорадки Рифт-Валли[62]. Фавипиравир показал ограниченную эффективность против вируса Зика в исследованиях на животных, но оказался менее эффективным, чем другие противовирусные препараты, такие как MK-608[63]. Агент также продемонстрировал некоторую эффективность против бешенства[64] и был использован экспериментально на некоторых людях, инфицированных этим вирусом[65].
Таутомерия
Возможная таутомерия фавипиравира была исследована компьютерными методами. Было обнаружено, что енольная форма была существенно более стабильной в водном растворе, чем кето-подобная форма, а это означает, что фавипиравир, вероятно, существует почти исключительно в енольной форме в водном растворе. При протонировании включается кето-форма. Однако эти результаты были связаны с необходимостью подтвердить это экспериментально[66].
Эффективность и безопасность
Стиль этого раздела неэнциклопедичен или нарушает нормы русского языка. |
Фавипиравир может быть эффективен против вируса гриппа. Препарат может облегчать симптомы и снижать лихорадку. Однако то, что в 85 % клинических исследований результаты не опубликованы, не позволяет провести метаанализ и достоверно подтвердить эффективность фавипиравира[4].
В 2009 году фавипиравир считался нетоксичным для млекопитающих, поскольку не ингибирует синтез их собственных РНК или ДНК[67].
Доктор медицинских наук Василий Власов, профессор НИУ ВШЭ, выступил против применения этого препарата для терапии COVID-19, выразил свои сомнения в эффективности этого препарата и дженериков на его основе[10][68].
В нерандомизированных клинических исследованиях фавипиравир показал улучшение КТ грудной клетки экспериментальной группы по сравнению с контрольной группой, со степенью улучшения 91,43% против 62,22% при COVID-19[69].
По данным живого систематического обзора и метаанализа The BMJ может снижать время до клинического выздоровления (разрешения симптомов), а также срок госпитализации, степень достоверности доказательств низкая[70].
Исследования
При выдаче разрешения на ограниченное использование в Японии в 2014 году PMDAruen указало на отсутствие полного спектра исследований препарата и предписало производителю провести их и опубликовать результаты[71].
В 2014 году некоторые исследователи высказывали предположение о потенциале фавипиравира для лечения геморрагической лихорадки Эболы[72][73]. Но проведённое впоследствии клиническое исследование в Гвинее имеет серьёзные недостатки методики и ничего не доказывает[74].
In vitro и на животных также была замечена некоторая эффективность фавипиравира против вируса бешенства[75], однако, будучи однажды экспериментально применён у человека, он не спас пациента от смерти[76].
Фавипиравир изучается в качестве потенциального средства лечения COVID-19. В Китае начато исследование в феврале 2020[77][78], в Японии — в марте 2020[79]. В марте 2020 года также начались испытания в Италии[80]. В апреле 2020 года специалисты ВОЗ отложили обсуждение включения фавипиравира в исследование Solidarity из-за недостатка исследований и доказательств его эффективности[81]. В апреле-мае 2020 года в России было начато три клинических исследования III фазы[6][82][83][84][85][86]. В июле 2020 года, после завершения клинического испытания на 89 пациентах, японские исследователи в интервью сообщили, что не смогли обнаружить у фавипиравира терапевтический эффект при лечении им COVID-19[23]. В России 5 августа были опубликованы промежуточные результаты исследования TL-FVP-t[87].
К середине 2020 года были завершены 14 клинических испытаний фавипиравира как лекарства для лечения разных заболеваний, при этом результаты опубликованы только в одном испытании 2 фазы и одном — третьей, у 12 исследований результаты недоступны для анализа[88]. В одном исследовании второй фазы показано, что препарат клинически эффективен против вирусов гриппа, при этом отсутствовали смертность и серьёзные побочные эффекты. В другом исследовании третьей фазы сделан вывод, что препарат может облегчать симптомы и снижать лихорадку. Отсутствие опубликованных результатов для остальных клинических испытаний не позволяет провести метаанализ, из-за чего для серьёзных утверждений об эффективности препарата нет оснований[4].
Примечания
- ↑ 1 2 3 Yin‐Xiao Du, Xiao‐Ping Chen. Favipiravir: pharmacokinetics and concerns about clinical trials for 2019-nCoV infection (англ.) // Clinical pharmacology and therapeutics[en]. — 2020. — 4 April. — doi:10.1002/cpt.1844. — PMID 32246834.
- ↑ 1 2 3 Kimiyasu Shiraki, Tohru Daikoku. Favipiravir, an anti-influenza drug against life-threatening RNA virus infections (англ.) // Pharmacology & Therapeutics. — 2020. — May (vol. 209). — P. 107512. — ISSN 0163-7258. — doi:10.1016/j.pharmthera.2020.107512. — PMID 32097670 pmc=7102570.
- ↑ Furuta, Y. In Vitro and In Vivo Activities of Anti-Influenza Virus Compound T-705 : [англ.] / Y. Furuta, K. Takahashi, Y. Fukuda … [et al.] // Antimicrobial Agents and Chemotherapy. — 2002. — Vol. 46, no. 4. — P. 977—981. — doi:10.1128/AAC.46.4.977-981.2002. — PMID 11897578. — PMC 127093.

- ↑ 1 2 3 Khambholja & Asudani, 2020.
- ↑ 1 2 3 Гончаренко Р. Авифавир - новое российское лекарство от коронавируса? / Роман Гончаренко // DW. — 2020. — 11 июня.
- ↑ 1 2 Яланская А. Что известно о зарегистрированном для лечения COVID-19 препарате «Авифавир» / Анастасия Яланская // Парламентская газета. — 2020. — 1 июня.
- ↑ 1 2 3 Shiraki K, Daikoku T (February 2020). “Favipiravir, an anti-influenza drug against life-threatening RNA virus infections”. Pharmacology & Therapeutics. 209: 107512. DOI:10.1016/j.pharmthera.2020.107512. PMID 32097670.
- ↑ 1 2 3 Pilkington, V. A review of the safety of favipiravir – a potential treatment in the COVID-19 pandemic? : [англ.] / V. Pilkington, V. Pilkington, T. Pepperrell … [et al.] // Journal of Virus Eradication. — 2020. — Vol. 6, no. 2 (April). — P. 45–51. — ISSN 2055-6640. — doi:10.1016/S2055-6640(20)30016-9. — PMID 32405421. — PMC 7213073.
- ↑ 1 2 Kimiyasu Shiraki, Tohru Daikoku. Favipiravir, an anti-influenza drug against life-threatening RNA virus infections (англ.) // Pharmacology & therapeutics : journal. — 2020. — 22 February (vol. 209). — P. 107512. — doi:10.1016/j.pharmthera.2020.107512. — PMID 32097670.
- ↑ 1 2 Андрей Заякин. Фавипиравир. Неэффективен и очень опасен. Новая Газета (13 июля 2020).
- ↑ FMDA, 2011, p. 3,45: «…favipiravir has the risk of teratogenicity, etc.».
- ↑ Jin Z. et al. The ambiguous base-pairing and high substrate efficiency of T-705 (Favipiravir) Ribofuranosyl 5'-triphosphate towards influenza A virus polymerase (англ.) // PLOS One : journal. — Public Library of Science, 2013. — Vol. 8, no. 7. — P. e68347. — doi:10.1371/journal.pone.0068347. — . — PMID 23874596.
- ↑ Baranovich T. et al. T-705 (favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro (англ.) // Journal of Virology[en] : journal. — 2013. — April (vol. 87, no. 7). — P. 3741—3751. — doi:10.1128/JVI.02346-12. — PMID 23325689.
- ↑ Guedj J. et al. Antiviral efficacy of favipiravir against Ebola virus: A translational study in cynomolgus macaques (англ.) // PLOS Medicine[en] : journal. — 2018. — March (vol. 15, no. 3). — P. e1002535. — doi:10.1371/journal.pmed.1002535. — PMID 29584730.
- ↑ Smee D. F. et al. Intracellular metabolism of favipiravir (T-705) in uninfected and influenza A (H5N1) virus-infected cells (англ.) // The Journal of Antimicrobial Chemotherapy[en] : journal. — 2009. — October (vol. 64, no. 4). — P. 741—746. — doi:10.1093/jac/dkp274. — PMID 19643775.
- ↑ Naesens L. et al. Role of human hypoxanthine guanine phosphoribosyltransferase in activation of the antiviral agent T-705 (favipiravir) (англ.) // Molecular Pharmacology[en] : journal. — 2013. — October (vol. 84, no. 4). — P. 615—629. — doi:10.1124/mol.113.087247. — PMID 23907213.
- ↑ 条件付き承認で普及に足かせ 富山化学インフル薬の"無念" (яп.). diamond.jp. Дата обращения: 25 февраля 2014.
- ↑ Koons, Cynthia. Ebola Drug From Japan May Emerge Among Key Candidates : [англ.] // Bloomberg. — 2014. — 7 August.
- ↑ Hayden F. G., Shindo N. Influenza virus polymerase inhibitors in clinical development (англ.) // Current Opinion in Infectious Diseases[en]. — Lippincott Williams & Wilkins, 2019. — Vol. 32, no. 2. — P. 176—186. — doi:10.1097/QCO.0000000000000532. — PMID 30724789.

- ↑ Zhang Yangfei. Potential coronavirus drug approved for marketing (англ.). China Daily. Дата обращения: 21 марта 2020.
- ↑ Константин Журавлёв. Минздрав одобрил препарат РФПИ и «ХимРара» от коронавируса. Газета.ру (30 мая 2020).
- ↑ Государственный реестр лекарственных средств
- ↑ 1 2 3 Swift R. Fujifilm's Avigan inconclusive in COVID-19 patients in Japan trial : [англ.] : [арх. 10 июля 2020] / Reporting by Rocky Swift; Editing by Chris Gallagher and Chang-Ran Kim // Reuters. — 2020. — 10 July.
- ↑ 1 2 Теслина А. Фавипиравир не показал убедительной эффективности при COVID-19 / Анастасия Теслина // Фармвестник. — 2020. — 10 июля.
- ↑ 1 2 Первый препарат против COVID-19 «Авифавир» поступил в клиники семи регионов РФ. Интерфакс (11 июня 2020). Дата обращения: 15 ноября 2020.
- ↑ Минздрав РФ одобрил третий препарат для лечения коронавируса. Интерфакс (8 июля 2020). Дата обращения: 15 ноября 2020.
- ↑ MediVector Completes Patient Enrollment In Two Phase 3 Studies Of Favipiravir For Influenza. BioSpace. Дата обращения: 5 мая 2020.
- ↑ Lumby, Casper (3 March 2020). “Favipiravir and Zanamivir Cleared Infection with Influenza B in a Severely Immunocompromised Child”. Clinical Infectious Diseases. 71 (7): e191—e194. DOI:10.1093/cid/ciaa023. PMID 32124919.
- ↑ Hayden FG, Shindo N (April 2019). “Influenza virus polymerase inhibitors in clinical development”. Current Opinion in Infectious Diseases. 32 (2): 176—186. DOI:10.1097/QCO.0000000000000532. PMC 6416007. PMID 30724789.

- ↑ Conditional approval hampers popularization Toyama Chemical's flu drug "remorse" (яп.). Дата обращения: 25 февраля 2014.
- ↑ 'FabiFlu is the most economical COVID-19 treatment option': Glenmark's reply to Centre on alleged 'overpricing'. DNA India (21 July 2020). Дата обращения: 22 июля 2020.
- ↑ Favipira - Tablet - 200 mg - Beacon Pharmaceuticals Ltd. - Indications, Pharmacology, Dosage, Side Effects & other Generic Info. Medex. Дата обращения: 22 июля 2020.
- ↑ Agrawal U, Raju R, Udwadia ZF (September 2020). “Favipiravir: A new and emerging antiviral option in COVID-19”. Medical Journal, Armed Forces India. 76 (4): 370—376. DOI:10.1016/j.mjafi.2020.08.004. PMID 32895599.
- ↑ Li G, De Clercq E. Therapeutic options for the 2019 novel coronavirus (2019-nCoV). Nature Reviews Drug Discovery 2020 February doi:10.1038/d41573-020-00016-0
- ↑ Brief –Corrected – Zhejiang Hisun Pharma gets approval for clinical trial to test flu drug Favipiravir for pneumonia caused by new coronavirus. Reuters Healthcare, February 16, 2020.
- ↑ Fujifilm Announces the Start of a Phase III Clinical Trial of Influenza Antiviral Drug Avigan (favipiravir) on COVID-19 in Japan and Commits to Increasing Production (англ.). Drugs.com. Дата обращения: 12 апреля 2020.
- ↑ Cai Q, Yang M, Liu D, Chen J, Shu D, Xia J, et al. (2020-03-18). “Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study”. Engineering [англ.]. DOI:10.1016/j.eng.2020.03.007. ISSN 2095-8099. PMID 32346491.
- ↑ Dong L, Hu S, Gao J (2020). “Discovering drugs to treat coronavirus disease 2019 (COVID-19)”. Drug Discoveries & Therapeutics. 14 (1): 58—60. DOI:10.5582/ddt.2020.01012. PMID 32147628.
- ↑ 1 2 Yangfei, Zhang Potential coronavirus drug approved for marketing. Chinadaily.com.cn. Дата обращения: 21 марта 2020.
- ↑ Coronavirus, il Veneto sperimenta l'antivirale giapponese Favipiravir. Ma l'Aifa: "Ci sono scarse evidenze scientifiche su efficacia" (неопр.). Il Fatto Quotidiano (22 марта 2020). Дата обращения: 23 марта 2020.
- ↑ AIFA precisa, uso favipiravir per COVID-19 non autorizzato in Europa e USA, scarse evidenze scientifiche sull'efficacia (неопр.). aifa.gov.it. Дата обращения: 23 марта 2020.
- ↑ Favipiravir to Treat COVID-19: Q&A with Boris Juelg, MD, PhD (англ.). Mass General Advances in Motion. Дата обращения: 29 апреля 2020.
- ↑ UK coronavirus patients set to trial 'promising' Japanese-made drug (англ.). London Evening Standard. Дата обращения: 2 мая 2020.
- ↑ Medicine registration license ЛП-006225. Government registry of medicines. Russian Ministry of Health. Дата обращения: 30 мая 2020.
- ↑ Adaptive multi-center randomized open-label comparative clinical study of the effectiveness and safety of the medicine favipiravir in patients hospitalized with COVID-19. Registry of approvals for the conduct of clinical studies. Russian Ministry of Health. Дата обращения: 30 мая 2020.
- ↑ Russian Ministry of Health approves the first COVID-19 drug Avifavir produced by JV of RDIF and ChemRar, RDIF (30 May 2020). Дата обращения 31 мая 2020.
- ↑ Russian Health Ministry approves anti-coronavirus drug Avifavir, BNN Bloomberg (31 May 2020). Дата обращения 31 мая 2020.
- ↑ Russia plans coronavirus vaccine clinical trials in two weeks - report, Reuters (30 May 2020). Дата обращения 31 мая 2020.
- ↑ 96% of Covid-19 patients recover in Beacon pharma's Favipira trial.
- ↑ Gatherer D (August 2014). “The 2014 Ebola virus disease outbreak in West Africa”. The Journal of General Virology. 95 (Pt 8): 1619—1624. DOI:10.1099/vir.0.067199-0. PMID 24795448.
- ↑ Oestereich L, Lüdtke A, Wurr S, Rieger T, Muñoz-Fontela C, Günther S (May 2014). “Successful treatment of advanced Ebola virus infection with T-705 (favipiravir) in a small animal model”. Antiviral Research. 105: 17—21. DOI:10.1016/j.antiviral.2014.02.014. PMID 24583123.
- ↑ Smither SJ, Eastaugh LS, Steward JA, Nelson M, Lenk RP, Lever MS (April 2014). “Post-exposure efficacy of oral T-705 (Favipiravir) against inhalational Ebola virus infection in a mouse model”. Antiviral Research. 104: 153—5. DOI:10.1016/j.antiviral.2014.01.012. PMID 24462697.
- ↑ First French Ebola patient leaves hospital, Reuters (4 October 2016).
- ↑ Guinea: Clinical Trial for Potential Ebola Treatment Started in MSF Clinic in Guinea. AllAfrica – All the Time. Дата обращения: 28 декабря 2014.
- ↑ Sissoko D, Laouenan C, Folkesson E, M'Lebing AB, Beavogui AH, Baize S, et al. (March 2016). “Experimental Treatment with Favipiravir for Ebola Virus Disease (the JIKI Trial): A Historically Controlled, Single-Arm Proof-of-Concept Trial in Guinea”. PLOS Medicine. 13 (3): e1001967. DOI:10.1371/journal.pmed.1001967. PMC 4773183. PMID 26930627.
- ↑ Fink, Sheri. Ebola Drug Aids Some in a Study in West Africa, The New York Times (4 February 2015).
- ↑ Cohen, Jon (26 February 2015). “Results from encouraging Ebola trial scrutinized”. Science. DOI:10.1126/science.aaa7912. Дата обращения 21 January 2016.
- ↑ Banerjee, Sayantan; Gupta, Nitin; Kodan, Parul; Mittal, Ankit; Ray, Yogiraj; Nischal, Neeraj; Soneja, Manish; Biswas, Ashutosh; Wig, Naveet (February 2019). “Nipah virus disease: A rare and intractable disease”. Intractable & Rare Diseases Research. 8 (1): 1—8. DOI:10.5582/irdr.2018.01130. ISSN 2186-3644. PMC 6409114. PMID 30881850.
- ↑ Dawes, Brian E.; Kalveram, Birte; Ikegami, Tetsuro; Juelich, Terry; Smith, Jennifer K.; Zhang, Lihong; Park, Arnold; Lee, Benhur; Komeno, Takashi; Furuta, Yousuke; Freiberg, Alexander N. (15 May 2018). “Favipiravir (T-705) protects against Nipah virus infection in the hamster model”. Scientific Reports. 8 (1): 7604. Bibcode:2018NatSR...8.7604D. DOI:10.1038/s41598-018-25780-3. ISSN 2045-2322. PMC 5954062. PMID 29765101.
- ↑ Furuta Y, Takahashi K, Shiraki K, Sakamoto K, Smee DF, Barnard DL, et al. (June 2009). “T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections”. Antiviral Research. 82 (3): 95—102. DOI:10.1016/j.antiviral.2009.02.198. PMID 19428599.
- ↑ Furuta Y, Gowen BB, Takahashi K, Shiraki K, Smee DF, Barnard DL (November 2013). “Favipiravir (T-705), a novel viral RNA polymerase inhibitor”. Antiviral Research. 100 (2): 446—54. DOI:10.1016/j.antiviral.2013.09.015. PMC 3880838. PMID 24084488.
- ↑ Caroline AL, Powell DS, Bethel LM, Oury TD, Reed DS, Hartman AL (April 2014). “Broad spectrum antiviral activity of favipiravir (T-705): protection from highly lethal inhalational Rift Valley Fever”. PLOS Neglected Tropical Diseases. 8 (4): e2790. DOI:10.1371/journal.pntd.0002790. PMC 3983105. PMID 24722586.
- ↑ Mumtaz N, van Kampen JJ, Reusken CB, Boucher CA, Koopmans MP (2016). “Zika Virus: Where Is the Treatment?”. Current Treatment Options in Infectious Diseases. 8 (3): 208—211. DOI:10.1007/s40506-016-0083-7. PMC 4969322. PMID 27547128.
- ↑ Yamada K, Noguchi K, Komeno T, Furuta Y, Nishizono A (April 2016). “Efficacy of Favipiravir (T-705) in Rabies Postexposure Prophylaxis”. The Journal of Infectious Diseases. 213 (8): 1253—61. DOI:10.1093/infdis/jiv586. PMC 4799667. PMID 26655300.
- ↑ Murphy J, Sifri CD, Pruitt R, Hornberger M, Bonds D, Blanton J, et al. (January 2019). “Human Rabies - Virginia, 2017”. MMWR. Morbidity and Mortality Weekly Report [англ.]. 67 (5152): 1410—1414. DOI:10.15585/mmwr.mm675152a2. PMC 6334827. PMID 30605446.
- ↑ Antonov L (2020). “Favipiravir tautomerism: a theoretical insight”. Theoretical Chemistry Accounts. 139 (8): 145. DOI:10.1007/s00214-020-02656-2. PMID 32834770.
- ↑ T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections (англ.) // Antiviral Research[en] : journal. — 2009. — June (vol. 82, no. 3). — P. 95—102. — doi:10.1016/j.antiviral.2009.02.198. — PMID 19428599.
- ↑ «Это бизнес, это не имеет отношения к науке и фармацевтике»: доктор медицины о препарате от COVID-19, Навальный Лайф (25 сентября 2020).
- ↑ Ahmed Wadaa-Allah, Marwa S. Emhamed, Mohammed A. Sadeq, Nesrine Ben Hadj Dahman, Irfan Ullah. Efficacy of the current investigational drugs for the treatment of COVID-19: a scoping review // Annals of Medicine. — Т. 53, вып. 1. — С. 318–334. — ISSN 0785-3890. — doi:10.1080/07853890.2021.1875500.
- ↑ Reed AC Siemieniuk, Jessica J. Bartoszko, Long Ge, Dena Zeraatkar, Ariel Izcovich. Drug treatments for covid-19: living systematic review and network meta-analysis (англ.) // BMJ. — 2020-07-30. — Vol. 370. — P. m2980. — ISSN 1756-1833. — doi:10.1136/bmj.m2980.
- ↑ FMDA, 2011, p. 1,172.
- ↑ Gatherer D. The 2014 Ebola virus disease outbreak in West Africa (англ.) // Journal of General Virology. — Microbiology Society[en], 2014. — August (vol. 95, no. Pt 8). — P. 1619—1624. — doi:10.1099/vir.0.067199-0. — PMID 24795448.

- ↑ Smither S. J. et al. Post-exposure efficacy of oral T-705 (Favipiravir) against inhalational Ebola virus infection in a mouse model (англ.) // Antiviral Research[en]. — 2014. — April (vol. 104). — P. 153—155. — doi:10.1016/j.antiviral.2014.01.012. — PMID 24462697.
- ↑ Cohen J. Results from encouraging Ebola trial scrutinized : [англ.] // Science Insider : электр. ресурс. — 2015. — February. — doi:10.1126/science.aaa7912.
- ↑ Yamada K. et al. Efficacy of Favipiravir (T-705) in Rabies Postexposure Prophylaxis (англ.) // The Journal of Infectious Diseases. — 2016. — April (vol. 213, no. 8). — P. 1253—1261. — doi:10.1093/infdis/jiv586. — PMID 26655300.
- ↑ Murphy J. et al. Human Rabies – Virginia, 2017 (англ.) // MMWR. Morbidity and Mortality Weekly Report : journal. — 2019. — January (vol. 67, no. 5152). — P. 1410—1414. — doi:10.15585/mmwr.mm675152a2. — PMID 30605446.
- ↑ Li G., De Clercq E. Therapeutic options for the 2019 novel coronavirus (2019-nCoV) (англ.) // Nature Reviews Drug Discovery. — 2020. — Vol. 19, iss. February. — P. 149—150. — doi:10.1038/d41573-020-00016-0.

- ↑ Brief -Corrected — Zhejiang Hisun Pharma gets approval for clinical trial to test flu drug Favipiravir for pneumonia caused by new coronavirus. Reuters Healthcare, February 16, 2020.
- ↑ Fujifilm Announces the Start of a Phase III Clinical Trial of Influenza Antiviral Drug Avigan (favipiravir) on COVID-19 in Japan and Commits to Increasing Production (англ.). Drugs.com. Дата обращения: 12 апреля 2020.
- ↑ Coronavirus, il Veneto sperimenta l'antivirale giapponese Favipiravir. Ma l'Aifa: "Ci sono scarse evidenze scientifiche su efficacia" (итал.). Il Fatto Quotidiano (22 marzo 2020). Дата обращения: 23 марта 2020.
- ↑ COVID-19 : Informal consultation on the potential inclusion of Favipiravir in a clinical trial : Draft : [англ.]. — Geneva : WHO, 2020. — 10 April. — 19 p. — (WHO R&D Blueprint).
- ↑ «Р-Фарм» и «Промомед» начали КИ фавипиравира от COVID-19. Vademecum (22 мая 2020). Дата обращения: 29 июня 2020.
- ↑ ЛП Фавипиравир: арепливир(промомед) фавипиравир-тл фавипиравир (кромис) (203,201,180 от 2020) — Реестр Клинических Исследований. — ГРЛС России.
- ↑ РКИ № 180 (23.04.2020) COVID-FPR-01
- ↑ Первый эффективный российский препарат от COVID-19 назвали «Авифавир». — Известия : газ. — 22 мая 2020
- ↑ Препарат против коронавируса «Фавипиравир» в РФ будет называться «Авифавир» — ТАСС : [электр. ресурс] — 22 мая 2020
- ↑ «Медицинский оппонент», № 1 (9) ИЮЛЬ 2020; 48-58 Руженцова. Возможности этиотропной терапии коронавирусной инфекции, вызванной SARS-CoV-2, у амбулаторных пациентов
- ↑ Khambholja & Asudani, 2020, Table 1.
Литература
- Khambholja K. Potential repurposing of Favipiravir in COVID-19 outbreak based on current evidence : [англ.] / Kapil Khambholja, Deepak Asudani // Travel Medicine and Infectious Disease. — 2020. — Vol. 35. — P. 101710. — 2 p. — ISSN 1477-8939. — doi:10.1016/j.tmaid.2020.101710. — PMID 32360327. — PMC 7252084.
- Report on the deliberation results – avigan : [англ.] / Evaluation and Licensing Division, Pharmaceutical and Food Safety Bureau. — Japan : Pharmaceuticals and Medical Devices Agency, 2011. — 172 p.
Документы
- Регистрационное удостоверение ЛП-006225 : Авифавир // Государственный реестр лекарственных средств. — Минздрав РФ, 2020. — 29 мая.
- Регистрационное удостоверение ЛП-006288 : Арепливир // Государственный реестр лекарственных средств. — Минздрав РФ, 2020. — 23 июня.
- Блинов, А. А. Инструкция по медицинскому применению лекарственного препарата Авифавир : ЛП-006225-290520 / ООО «Кромис». — Министерство здравоохранения Российской Федерации, 2020. — 29 мая. — 8 с.
Ссылки
- Drug Name: Favipiravir [USAN:INN:JAN] (англ.). Drug Information Portal. U. S. National Library of Medicine.
Информация
Статья Фавипиравир в русской Википедии заняла в местном рейтинге популярности следующие места:
- 26-е место 2020-05-30
- 19-е место 2020-05-31
- 26-е место 2020-06-01
- 93-е место 2020-06-02
- 42-е место 2020-06-05
- 31-е место 2020-06-11
- 63-е место 2020-07-02
- 10-е место 2020-09-18
- 23-е место 2020-09-19
- 61-е место 2020-09-20
- 6-е место 2020-09-21
- 36-е место 2020-09-22
- 60-е место 2020-09-23
- 70-е место 2020-09-24
- 69-е место 2020-10-16
О странице
Представленный контент статьи из Википедии был извлечен 2021-06-13 на основе https://ru.wikipedia.org/?curid=8285272