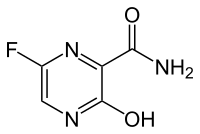
Favipiravir
| Favipiravir | |
|---|---|
| Nome IUPAC | |
| 6-fluoro-3-idrossi-2-pirazinecarbossammide | |
| Nomi alternativi | |
| T-705 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H4FN3O2 |
| Numero CAS | |
| Codice ATC | J05 |
| PubChem | 492405 |
| DrugBank | DB12466 |
| SMILES | C1=C(N=C(C(=O)N1)C(=O)N)F |
| Dati farmacologici | |
| Categoria farmacoterapeutica | antivirale |
| Indicazioni di sicurezza | |
Il Favipiravir, noto anche come T-705 (commercializzato come Avigan o Favilavir), è un farmaco antivirale che possiede un'attività diretta contro molti virus a RNA. È stato sviluppato dalla Toyama Kagaku Kōgyō, una consociata giapponese della Fujifilm Holdings Corporation.
Chimicamente è un 6-fluoro-3-idrossi-2-pirazinecarbossammide.[1] Come alcuni farmaci antivirali sperimentali (T-1105 e T-1106), è un derivato della pirazinecarbossammide.
Storia
Il favipiravir è stato sviluppato, con brevetto del 1999, dalla Toyama Kagaku Kōgyō, una consociata della Fujifilm Holdings Corp.
In origine, il favipiravir doveva essere commercializzato in Giappone come farmaco antinfluenzale, come analogo dell'oseltamivir.
Nel 2014, la Fujifilm ha presentato alla Food and Drug Administration un'istanza per l'uso di pillole di favipiravir nel contrasto a ebolavirus.[2]
L'approvazione del farmaco in Giappone, a causa della sua teratogenicità,[3] prevede la somministrazione solo su ceppi virali per i quali non esistono altri farmaci efficaci; considerandolo un farmaco di riserva.[4][5]
Secondo quanto riportato dai media locali, il governo giapponese possiede circa 2 milioni di dosi di Avigan e lo fornirà alle istituzioni mediche, se necessario;[1] analogamente ha fatto Taiwan.[6]
Ricerca sull'utilizzo come trattamento per COVID-19
Nel febbraio 2020, il Favipiravir è stato studiato in Cina come trattamento sperimentale della malattia emergente COVID-19.[7][8][9] Ha ricevuto l'approvazione a breve termine in Cina il 16 febbraio 2020 come antivirale, e viene prodotto in Cina con il nome di Favilavir.[10]
Il 16 marzo 2020 la Corea del Sud ha dichiarato che non avrebbe importato il farmaco per il trattamento di COVID-19.[5] La scelta è stata motivata dai dubbi sulla sua efficacia, dall'insufficiente sperimentazione sull'uomo e dalle perplessità sui gravi effetti collaterali rilevati sugli animali.[5]
In Italia, il 22 marzo 2020, l'AIFA ha autorizzato la sperimentazione del farmaco in Lombardia, Veneto e Emilia Romagna, per valutare l’impatto del farmaco nelle fasi iniziali della malattia[11][12]. L'AIFA ha sottolineato che le evidenze scientifiche a favore di questo farmaco siano basate soprattutto su un singolo studio preliminare, ma che la Commissione Tecnico-Scientifica dell'agenzia, riunita in seduta permanente, sottopone a valutazione ogni giorno tutte le evidenze.[13]
Il 24 marzo 2020, Chiaki Hasegawa, portavoce di Fujifilm Holdings Corp., ha espresso perplessità sull'utilizzo del farmaco sottolineando come il farmaco non fosse stato ancora sufficientemente sperimentato.[14]
Sia l'EMA europea che la FDA americana non ne hanno autorizzato l'utilizzo.[13]
Non esistono studi clinici pubblicati relativi alla sicurezza del farmaco o alla sua efficacia nel trattamento della malattia da COVID-19. Sono unicamente noti studi preliminari, disponibili attualmente solo come versione pre-proof.
Ricercatori cinesi hanno suggerito, in uno studio pre-proof (cioè non sottoposto a revisione di esperti) su 80 pazienti affetti da COVID-19 in forma lieve e con massimo 7 giorni di malattia alle spalle, che il farmaco potrebbe essere efficace nel trattamento della COVID-19 causata dal SARS-CoV-2.[15] In questo studio, il favipiravir ha accorciato a 4 giorni il decorso della malattia, rispetto agli 11 giorni dell'antivirale sperimentale lopinavir/ritonavir (anch'esso non autorizzato per COVID-19).[15][16] I pazienti trattati nello studio hanno riportato miglioramenti visibili con TAC (sempre rispetto a lopinavir/ritonavir) del 47%. Gli stessi autori dello studio segnalano che, non trattandosi di uno studio clinico controllato, ci potrebbero essere inevitabili distorsioni dovute alla selezione arbitraria dei pazienti reclutati.[15]
Ricercatori coreani, sempre in uno studio pre-proof, hanno osservato l'assenza di efficacia contro il virus COVID-19, a differenza di farmaci rivelatisi efficaci, quali Clorochina, lopinavir e remdesivir.[17]
Farmacocinetica
Il Favipiravir è un profarmaco che viene metabolizzato nella sua forma attiva, favipiravir-ribofuranosil-5'-trifosfato (favipiravir-RTP), disponibile in formulazioni sia orali sia endovenose.[18][19] Si ritiene che l'ipoxantina umana guanina-fosforibosiltransferasi (HGPRT) svolga un ruolo chiave in questo processo di attivazione.[20]
Il favipiravir non inibisce la sintesi di RNA o DNA nelle cellule di mammifero e non comporta tossicità significativa per esse.[21]
Farmacodinamica
Si ritiene che il meccanismo d'azione del farmaco sia correlato all'inibizione selettiva dell'RNA polimerasi-RNA-dipendente virale.[22] Altre ricerche suggeriscono che il favipiravir induce mutazioni letali dell'RNA virale, producendo un fenotipo virale non vitale.[23] Ricerche hanno anche scoperto che la presenza di analoghi delle purine possono ridurre l'attività antivirale di favipiravir, suggerendo la competizione tra favipiravir-RTP e nucleosidi purinici per il legame RdRp; il dominio catalitico RdRp sembra essere comune nei virus a RNA.[24]
Impiego clinico
Gli esperimenti sugli animali in Giappone ne mostrarono potenziali teratogenesi (lo sviluppo anormale di alcuni organi del feto durante la gravidanza). Per questo motivo, l'approvazione della produzione da parte del Ministero della salute giapponese fu notevolmente ritardata, per poi essere limitata ai soli casi di emergenza.[25]
Sempre in esperimenti condotti su animali, il Favipiravir ha dimostrato attività contro i virus influenzali, virus del Nilo occidentale, virus della febbre gialla, virus dell'afta epizootica, nonché altri flavivirus, arenavirus, bunyavirus e alphavirus.[26] Ne è stata anche dimostrata l'attività contro gli enterovirus[26] e il virus della febbre della Rift Valley.[27] Favipiravir ha mostrato una certa efficacia contro il virus Zika negli studi sugli animali, pur essendo stato meno efficace di altri antivirali come MK-608 della Merck & Co.[28] Nel 2013, uno studio in vitro ha mostrato la capacità di favipiravir di indurre in H1N1 delle mutagenesi che ne riducono l'infettività[29].
Durante l'epidemia di Ebola del 2014, il Giappone si è offerto di fornire il favipiravir, ove necessario.[30]
Nell'ottobre del 2014, un'infermiera francese di MSF in Liberia è sopravvissuta all'infezione del ebolavirus, dopo essere stata trattata con favipiravir.[31]
L'OMS aveva infatti dichiarato eticamente accettabile, nel corso dell'epidemia di Ebola 2014, la somministrazione di medicinali preventivi o terapeutici, anche senza prove della loro efficacia nell'uomo, purché i risultati sperimentali indicassero almeno una efficacia sugli animali.[32]
Nel marzo del 2015, la Medivector Inc, una società di biotecnologie del Massachusetts, ha completato uno studio clinico di fase III, diretto dalla Dott.sa Carol A. Epstein, finalizzata a studiare la sicurezza e l'efficacia di Favipiravir nel trattamento dell'influenza. A marzo 2020, non sono ancora stati pubblicati gli esiti dello studio.[33]
In una ricerca del 2015, il farmaco ha mostrato una certa efficacia anche contro il virus della rabbia (in vitro e in vivo sui topi)[34]. Tuttavia, nel 2017, l'utilizzo sperimentale su una paziente umana infetta dal virus, non ha contrastato il fatale decorso della malattia[35].
Nel 2018, uno studio della American Society for Microbiology, ha dimostrato che favipiravir ha una scarsa attività antivirale nelle cellule respiratorie umane primarie.[36]
Il 30 Maggio 2020, Il Ministero della Salute russo ha approvato una versione generica di favipiravir denominata Avifavir. RFID ha sostenuto lo sviluppo di Avifavir lo ha trovato altamente efficace nella prima fase degli studi clinici.[senza fonte]
Effetti collaterali noti
Il Favipiravir è teratogeno, ossia può causare lo sviluppo anormale di alcuni organi del feto durante la gravidanza. Pertanto, nelle donne con gravidanza confermata o sospettata, la somministrazione deve essere evitata.[3][24]
Dati prodotti su animali da esperimento indicano: effetti avversi sui tessuti ematopoietici, come riduzione della produzione di globuli rossi, e aumento degli indici di citolisi epatica e colestasi, come l'aspartato aminotransferasi (AST), la fosfatasi alcalina (ALP), la alanina aminotransferasi (ALT) e la bilirubina totale ed un aumento della vacuolizzazione negli epatociti.
È stata anche osservata una tossicità sul testicolo.[37]
Note
- ^ a b Japan Testing Flu Medication Treatment Against COVID-19 Disease — Precision Vaccinations, precisionvaccinations.com. URL consultato il 21 marzo 2020.
- ^ Cynthia Koons, Ebola Drug From Japan May Emerge Among Key Candidates, Bloomberg.com, 7 agosto 2014.
- ^ a b Delang L, Abdelnabi R, Neyts J, Favipiravir as a potential countermeasure against neglected and emerging RNA viruses, in Antiviral Res., vol. 153, May 2018, pp. 85–94, DOI:10.1016/j.antiviral.2018.03.003, PMID 29524445.
- ^ Hayden FG, Shindo N, Influenza virus polymerase inhibitors in clinical development, in Curr. Opin. Infect. Dis., vol. 32, n. 2, April 2019, pp. 176–186, DOI:10.1097/QCO.0000000000000532, PMC 6416007, PMID 30724789.
- ^ Taiwan's government organization decides to stockpile Fujifilm's anti-influenza drug “Avigan® Tablet” —Fujifilm supplies Avigan® Tablet to Taiwan—, fujifilm.com.au. URL consultato il 21 marzo 2020.
- ^ (EN) Justin McCurry, Japanese flu drug 'clearly effective' in treating coronavirus, says China, in The Guardian, 18 marzo 2020. URL consultato il 21 marzo 2020.
- ^ Li G, De Clercq E. Therapeutic options for the 2019 novel coronavirus (2019-nCoV). Nature Reviews Drug Discovery 2020 Feb DOI: 10.1038/d41573-020-00016-0
- ^ BRIEF-Corrected-Zhejiang Hisun Pharma gets approval for clinical trial to test flu drug Favipiravir for pneumonia caused by new coronavirus. Reuters Healthcare, February 16, 2020.
- ^ Coronavirus, il Veneto sperimenta l'antivirale giapponese Favipiravir. Ma l'Aifa: "Ci sono scarse evidenze scientifiche su efficacia", su Il Fatto Quotidiano, 22 marzo 2020. URL consultato il 22 marzo 2020.
- ^ Covid-19: Speranza, “Aifa procede su sperimentazione Avigan”, su la Repubblica, 23 marzo 2020. URL consultato il 3 aprile 2020.
- ^ a b AIFA precisa, uso favipiravir per COVID-19 non autorizzato in Europa e USA, scarse evidenze scientifiche sull’efficacia, su aifa.gov.it. URL consultato il 22 marzo 2020.
- ^ a b c (EN) Qingxian Cai, Minghui Yang e Dongjing Liu, Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study, in Engineering, 18 marzo 2020, DOI:10.1016/j.eng.2020.03.007. URL consultato il 2020-03 21.
- ^ (EN) Sangeun Jeon et al., Identification of antiviral drug candidates against SARS-CoV-2 from FDA-approved drugs (PDF), biorxiv.org, p. 5. URL consultato il 23 marzo 2020.
- ^ Guedj J, Piorkowski G, Jacquot F, Madelain V, Nguyen TH, Rodallec A, Gunther S, Carbonnelle C, Mentré F, Raoul H, de Lamballerie X, Antiviral efficacy of favipiravir against Ebola virus: A translational study in cynomolgus macaques, in PLoS Medicine, vol. 15, n. 3, March 2018, pp. e1002535, DOI:10.1371/journal.pmed.1002535, PMC 5870946, PMID 29584730.
- ^ Smee DF, Hurst BL, Egawa H, Takahashi K, Kadota T, Furuta Y, Intracellular metabolism of favipiravir (T-705) in uninfected and influenza A (H5N1) virus-infected cells, in The Journal of Antimicrobial Chemotherapy, vol. 64, n. 4, October 2009, pp. 741–46, DOI:10.1093/jac/dkp274, PMC 2740635, PMID 19643775.
- ^ Naesens L, Guddat LW, Keough DT, van Kuilenburg AB, Meijer J, Vande Voorde J, Balzarini J, Role of human hypoxanthine guanine phosphoribosyltransferase in activation of the antiviral agent T-705 (favipiravir), in Molecular Pharmacology, vol. 84, n. 4, October 2013, pp. 615–29, DOI:10.1124/mol.113.087247, PMID 23907213.
- ^ Furuta Y, Takahashi K, Shiraki K, Sakamoto K, Smee DF, Barnard DL, Gowen BB, Julander JG, Morrey JD, T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections, in Antiviral Research, vol. 82, n. 3, June 2009, pp. 95–102, DOI:10.1016/j.antiviral.2009.02.198, PMID 19428599.
- ^ Jin Z, Smith LK, Rajwanshi VK, Kim B, Deval J, The ambiguous base-pairing and high substrate efficiency of T-705 (Favipiravir) Ribofuranosyl 5'-triphosphate towards influenza A virus polymerase, in PLOS ONE, vol. 8, n. 7, 2013, pp. e68347, Bibcode:2013PLoSO...868347J, DOI:10.1371/journal.pone.0068347, PMC 3707847, PMID 23874596.
- ^ Baranovich T, Wong SS, Armstrong J, Marjuki H, Webby RJ, Webster RG, Govorkova EA, T-705 (favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro, in Journal of Virology, vol. 87, n. 7, April 2013, pp. 3741–51, DOI:10.1128/JVI.02346-12, PMC 3624194, PMID 23325689.
- ^ a b Furuta Y, Komeno T, Nakamura T, Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase, in Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci., vol. 93, n. 7, 2017, pp. 449–463, DOI:10.2183/pjab.93.027, PMC 5713175, PMID 28769016. URL consultato il 24 marzo 2020.
- ^ (JA) 条件付き承認で普及に足かせ 富山化学インフル薬の"無念", su diamond.jp. URL consultato il 25 febbraio 2014.
- ^ a b Furuta Y, Gowen BB, Takahashi K, Shiraki K, Smee DF, Barnard DL, Favipiravir (T-705), a novel viral RNA polymerase inhibitor, in Antiviral Research, vol. 100, n. 2, November 2013, pp. 446–54, DOI:10.1016/j.antiviral.2013.09.015, PMC 3880838, PMID 24084488.
- ^ Caroline AL, Powell DS, Bethel LM, Oury TD, Reed DS, Hartman AL, Broad spectrum antiviral activity of favipiravir (T-705): protection from highly lethal inhalational Rift Valley Fever, in PLoS Neglected Tropical Diseases, vol. 8, n. 4, April 2014, pp. e2790, DOI:10.1371/journal.pntd.0002790, PMC 3983105, PMID 24722586.
- ^ Mumtaz N, van Kampen JJ, Reusken CB, Boucher CA, Koopmans MP, Zika Virus: Where Is the Treatment?, in Current Treatment Options in Infectious Diseases, vol. 8, n. 3, 2016, pp. 208–11, DOI:10.1007/s40506-016-0083-7, PMC 4969322, PMID 27547128.
- ^ Tatiana Baranovich, Sook-San Wong e Jianling Armstrong, T-705 (favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro, in Journal of Virology, vol. 87, n. 7, 2013-04, pp. 3741–3751, DOI:10.1128/JVI.02346-12. URL consultato il 3 aprile 2020.
- ^ Ebola outbreak: Japan offers anti-influenza drug for treatment |, CBC News. URL consultato il 21 marzo 2020.
- ^ French nurse cured of Ebola, rfi.fr. URL consultato il 21 marzo 2020.
- ^ WHO | Ethical considerations for use of unregistered interventions for Ebola virus disease, WHO. URL consultato il 21 marzo 2020.
- ^ (EN) Phase 3 Efficacy and Safety Study of Favipiravir for Treatment of Uncomplicated Influenza in Adults - T705US316 - No Study Results Posted - ClinicalTrials.gov, ClinicalTrials.gov. URL consultato il 22 marzo 2020.
- ^ (EN) Kentaro Yamada, Kazuko Noguchi e Takashi Komeno, Efficacy of Favipiravir (T-705) in Rabies Postexposure Prophylaxis, in The Journal of Infectious Diseases, vol. 213, n. 8, 15 aprile 2016, pp. 1253–1261, DOI:10.1093/infdis/jiv586. URL consultato il 3 aprile 2020.
- ^ (EN) Julia Murphy, Human Rabies — Virginia, 2017, in MMWR. Morbidity and Mortality Weekly Report, vol. 67, 2019, DOI:10.15585/mmwr.mm675152a2. URL consultato il 3 aprile 2020.
- ^ Yoon JJ, Toots M, Lee S, Lee ME, Ludeke B, Luczo JM, Ganti K, Cox RM, Sticher ZM, Edpuganti V, Mitchell DG, Lockwood MA, Kolykhalov AA, Greninger AL, Moore ML, Painter GR, Lowen AC, Tompkins SM, Fearns R, Natchus MG, Plemper RK, Orally Efficacious Broad-Spectrum Ribonucleoside Analog Inhibitor of Influenza and Respiratory Syncytial Viruses, in Antimicrobial Agents and Chemotherapy, vol. 62, n. 8, August 2018, pp. e00766–18, DOI:10.1128/AAC.00766-18, PMC 6105843, PMID 29891600.
- ^ (EN) www.pmda.go.jp (PDF), pmda.go.jp. URL consultato il 24 marzo 2020.
Bibliografia
Testi
- Daniel Purich, The Inhibitor Index: A Desk Reference on Enzyme Inhibitors, Receptor Antagonists, Drugs, Toxins, Poisons, Biologics, and Therapeutic Leads, CRC Press, 20 luglio 2017, pp. 2–, ISBN 978-1-351-73067-9. Kazuo Tanaka, Yoshihito Niki e Akatsuki Kokaze, Current Topics of Infectious Diseases in Japan and Asia, Springer Science & Business Media, 8 settembre 2010, pp. 124–, ISBN 978-4-431-53875-2.
- Satya Prakash Gupta, Viral Proteases and Their Inhibitors, Elsevier Science, 3 luglio 2017, pp. 97–, ISBN 978-0-12-809682-6.
- Sunit K. Singh, Human Respiratory Viral Infections, CRC Press, 23 giugno 2014, pp. 403–, ISBN 978-1-4665-8321-4.
- Neuraminidase Inhibitors: Advances in Research and Application: 2011 Edition: ScholarlyPaper, ScholarlyEditions, 9 gennaio 2012, ISBN 978-1-4649-5716-1.
Riviste
- Madelain V, Mentré F, Baize S, Anglaret X, Laouénan C, Oestereich L, Nguyen THT, Malvy D, Piorkowski G, Graw F, Günther S, Raoul H, de Lamballerie X, Guedj J, Modeling favipiravir antiviral efficacy against emerging viruses: from animal studies to clinical trials, in [CPT: Pharmacometrics & Systems Pharmacology, March 2020, DOI:10.1002/psp4.12510, PMID 32198838.
- Shiraki K, Daikoku T, Favipiravir, an anti-influenza drug against life-threatening RNA virus infections, in Pharmacol. Ther., February 2020, pp. 107512, DOI:10.1016/j.pharmthera.2020.107512, PMID 32097670.
- Lampejo T, Influenza and antiviral resistance: an overview, in Eur. J. Clin. Microbiol. Infect. Dis., February 2020, DOI:10.1007/s10096-020-03840-9, PMID 32056049.
- Mifsud EJ, Hayden FG, Hurt AC, Antivirals targeting the polymerase complex of influenza viruses, in Antiviral Res., vol. 169, September 2019, pp. 104545, DOI:10.1016/j.antiviral.2019.104545, PMID 31247246.
- Principi N, Camilloni B, Alunno A, Polinori I, Argentiero A, Esposito S, Drugs for Influenza Treatment: Is There Significant News?, in Front Med (Lausanne), vol. 6, 2019, pp. 109, DOI:10.3389/fmed.2019.00109, PMC 6546914, PMID 31192211.
- Delang L, Abdelnabi R, Neyts J, Favipiravir as a potential countermeasure against neglected and emerging RNA viruses, in Antiviral Res., vol. 153, May 2018, pp. 85–94, DOI:10.1016/j.antiviral.2018.03.003, PMID 29524445.
- Furuta Y, Komeno T, Nakamura T, Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase, in Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci., vol. 93, n. 7, 2017, pp. 449–463, DOI:10.2183/pjab.93.027, PMC 5713175, PMID 28769016.
- (FR) Malvy D, Sissoko D, Camara AM, [Integrating clinical research into epidemic response: the field perspective in the Ebola experience], in Med Sci (Paris), vol. 33, n. 10, October 2017, pp. 891–897, DOI:10.1051/medsci/20173310022, PMID 28994386.
Voci correlate
Collegamenti esterni
- (EN) Avigan® Tablet 200mg administered to patients infected with Ebola virus | Fujifilm Global, fujifilm.com. URL consultato il 21 marzo 2020.
- (EN) Avigan - Search Results | Fujifilm Global, fujifilm.com. URL consultato il 21 marzo 2020.
- Aifa: "Uso favipiravir per Covid-19 non autorizzato in Europa e Usa, scarse evidenze scientifiche sull’efficacia", salute.gov.it. URL consultato il 23 marzo 2020.
- Avifavir, in Riferimento russo alla droga, Medum.ru.
Informazione
L'articolo Favipiravir in Wikipedia italiana ha preso i seguenti posti nella classifica di popolarità locale:
- 11 ° posto il 2020-03-21
- 1 ° posto il 2020-03-22
- 4 ° posto il 2020-03-23
- 21 ° posto il 2020-03-24
- 81 ° posto il 2020-03-25
Sulla pagina
Il contenuto presentato dell'articolo di Wikipedia è stato estratto 2021-06-12 sulla base di https://it.wikipedia.org/?curid=8380431