Coronavirus
Orthocoronavirinae
| Type | Virus |
|---|---|
| Domaine | Riboviria |
| Règne | Orthornavirae |
| Embranchement | Pisuviricota |
| Classe | Pisoniviricetes |
| Ordre | Nidovirales |
| Sous-ordre | Cornidovirineae |
| Famille | Coronaviridae |
Genres de rang inférieur
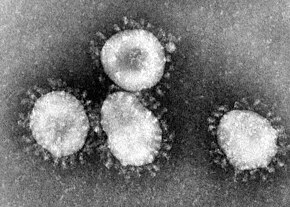
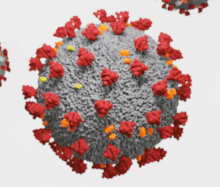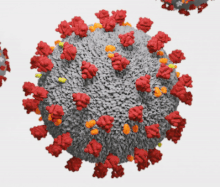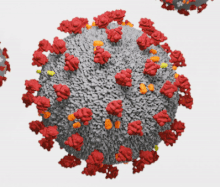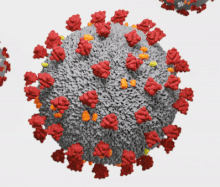
Les coronavirus (CoV) sont des virus qui constituent la sous-famille Orthocoronavirinae de la famille Coronaviridae. Le nom « coronavirus », du latin signifiant « virus à couronne », est dû à l'apparence des virions sous un microscope électronique, avec une frange de grandes projections bulbeuses qui évoquent une couronne solaire[2].
Les coronavirus sont munis d'une enveloppe virale incluant une capside caractérisée par des protéines en forme de massue (appelées spicules). Ils ont un génome à ARN monocaténaire (c'est-à-dire à un seul brin), de sens positif (groupe IV de la classification Baltimore), de 26 à 32 kilobases (ce qui en fait les plus grands génomes parmi les virus à ARN)[3]. Ils se classent parmi les Nidovirales, ordre de virus produisant un jeu imbriqué d'ARNm sous-génomiques lors de l'infection. Des spicules, une enveloppe, membrane et capside contribuent à la structure d'ensemble de tous les coronavirus. Ils peuvent muter et se recombiner[4].
Les chauves-souris et les oiseaux, en tant que vertébrés volants à sang chaud, seraient les hôtes idéaux pour les coronavirus assurant l'évolution et la dissémination du coronavirus[5]. Les coronavirus sont normalement spécifiques à un taxon animal comme hôte, mammifères ou oiseaux selon leur espèce ; mais ils peuvent parfois changer d'hôte à la suite d'une mutation. Leur transmission interhumaine se produit principalement par contacts étroits via des aérosols respiratoires générées par les éternuements, la toux ou la phonation. Plus de 500 types de coronavirus ont été isolées chez la chauve-souris et il existerait plus de 5 000 types de coronavirus[6].
Sept principaux coronavirus sont généralement cités comme pouvant contaminer l'humain[7]. Un huitième a été identifié : le B814[8] (le premier coronavirus humain identifié), mais cette souche semble ne plus circuler.
Quatre coronavirus en circulation sont considérés comme sources d'infection bénignes : 229E, NL63, OC43 et HKU1. Ils seraient la cause de 15 à 30 % des rhumes courants.
Plus récemment ont été identifiés trois types de coronavirus responsables de graves pneumopathies :
- le SARS-CoV, agent pathogène du syndrome respiratoire aigu sévère (SRAS) en 2002-2004
- le MERS-CoV, celui du syndrome respiratoire du Moyen-Orient à partir de 2012
- le SARS-CoV-2, celui de la maladie à coronavirus 2019 (Covid-19) apparue en Chine en 2019 et responsable d'une sévère pandémie en 2020-2021
Découverte, histoire

Les coronavirus existent probablement depuis au moins des centaines de millions d'années, mais du point de vue de l'épidémiologie et de l'histoire médicale et en tant que zoonose c'est au XXIe siècle qu'ils ont pris de l'importance : « cinq des sept coronavirus humains ont été isolés au cours de ce siècle. Et malheureusement, les trois derniers sont entrés dans notre vie avec les craintes liées à une épidémie, une pandémie ou à la mort »[9].
C'est en 1930 aux États-Unis que la première maladie due à un coronavirus est observée, chez des volailles. L'année suivante, un médecin décrit dans un article la maladie qui cause une détresse respiratoire chez la poule et une diminution de la ponte et de la qualité des œufs. En 1937, l'agent infectieux, le virus de la bronchite infectieuse aviaire (IBV pour Infectious Bronchitis Virus) est isolé.
En 1946, un autre coronavirus est identifié, le Coronavirus de la gastro-entérite transmissible porcine (TGEV). Indépendamment, en 1949 à New York et 1951 à Londres, deux équipes découvrent le virus de l'hépatite murine chez une souris paralysée[10].
En 1965, le premier coronavirus infectant l'être humain (la souche B814) est découvert. Et rapidement, d'autres suivent : 229E en 1966 et OC43 en 1967[11], qui sont la cause de rhumes plus ou moins graves selon les personnes. L'année suivante, ils sont observés au microscope électronique par June Almeida et David Tyrrell qui mettent en évidence leur structure en couronne[12]. La relation est faite entre tous ces virus, et le terme de « coronavirus » est pour la première fois utilisé dans la revue Nature en 1968[2],[10].
Épidémie du XXIe siècle
Le dernier coronavirus humain (ou récemment humanisé, très probablement à partir d'une ou plusieurs souches portées par des chauves-souris) semble avoir émergé à Wuhan en Chine en 2019 : le SARS-CoV-2. La maladie qu'il cause (Covid-19) a provoqué en quelques mois la première grande pandémie à coronavirus, caractérisée par un R0 élevé (2,3 en moyenne d'après les estimations disponibles en avril 2020, mais qui semble pouvoir atteindre 5,7) ; avec un taux de létalité de 6,3 (très variable selon les âges et les contextes, pouvant parfois dépasser 15%)[9].
| Pandémie | Date | Cas confirmés | Décès | Guérisons | Sous-type impliqué |
|---|---|---|---|---|---|
| Épidémie de SRAS de 2002-2004 | 2002-2004 | 8 096 | 774 | - | Sars-Cov (SRAS) |
| Coronavirus du syndrome respiratoire du Moyen-Orient | 2012-2014 | 361 | 107 | - | MERS-CoV |
| Pandémie de Covid-19 (En cours) | 2019-2021 | + 106 903 452 (10 février 2021)[13] | + 2 341 010 ()[13] | + 59 755 076 (10 février 2021)[13] | SARS-CoV-2 (Covid-19) |
Données de la pandémie de Sars-CoV-2 (2019-2021)
| Lieux | Confirmés | Décès | Rétablis | % morts par cas confirmés |
Morts par million hab. |
Réf |
|---|---|---|---|---|---|---|
| 200+ | 175 311 809 | 3 785 924 | – | – | – | [14] |
| 33 576 867 | 604 852 | – | 1,8 % | 1 844 | [15] | |
| 29 274 823 | 363 079 | 27 790 073 | 1,24 % | 274 | [16] | |
| 17 210 969 | 482 019 | 15 670 754 | 2,8 % | 2 294 | [17],[18] | |
| 5 725 492 | 110 231 | – | 1,93 % | 1 662 | [19],[20] | |
| 5 319 359 | 48 593 | 5 192 945 | 0,91 % | 581 | [21] | |
| 5 193 964 | 126 073 | 4 792 169 | 2,43 % | 859 | [22] | |
| 4 550 944 | 127 884 | – | 2,81 % | 1 953 | [23] | |
| 4 239 868 | 126 855 | 3 943 704 | 2,99 % | 2 103 | [24] | |
| 4 093 027 | 84 628 | 3 668 609 | 2,07 % | 1 883 | [25] | |
| 3 717 890 | 89 825 | 3 533 648 | 2,42 % | 1 080 | [26],[27] | |
| 3 729 458 | 80 465 | – | 2,16 % | 1 722 | [28] | |
| 3 665 137 | 94 046 | 3 409 076 | 2,57 % | 1 917 | [29] | |
| 3 003 112 | 81 672 | 2 612 091 | 2,72 % | 1 021 | [30] | |
| 2 877 243 | 74 562 | 2 648 207 | 2,59 % | 1 943 | [31] | |
| 2 448 820 | 229 823 | 1 950 419 | 9,39 % | 1 842 | [32] | |
| 2 222 701 | 51 646 | 2 125 685 | 2,32 % | 1 214 | [33],[34] | |
| 1 998 056 | 188 100 | 1 955 350 | 9,41 % | 6 402 | [35],[36] | |
| 1 901 490 | 52 730 | 1 740 436 | 2,77 % | 195 | [37] | |
| 1 730 106 | 57 592 | 1 598 293 | 3,33 % | 966 | [38],[39] | |
| 1 665 022 | 30 224 | 1 629 375 | 1,82 % | 2 824 | [40] | |
| 1 669 121 | 17 705 | – | 1,06 % | 1 045 | [41],[42] | |
| 1 461 419 | 30 472 | 1 382 124 | 2,09 % | 1 688 | [43] | |
| 1 399 716 | 25 886 | 1 355 419 | 1,85 % | 683 | [44],[45] | |
| 1 308 352 | 22 652 | 1 225 359 | 1,73 % | 224 | [46],[47] | |
| 1 246 860 | 16 668 | 1 164 103 | 1,34 % | 435 | [48] | |
| 1 079 657 | 31 804 | 1 044 000 | 2,95 % | 1 624 | [49] | |
| 1 083 456 | 14 574 | – | 1,35 % | 1 404 | [50] | |
| 1 074 988 | 25 075 | – | 2,33 % | 2 194 | [51],[52] | |
| 939 931 | 21 633 | 875 581 | 2,3 % | 100 | [53] | |
| 855 951 | 17 044 | 814 318 | 1,99 % | 1 655 | [54],[55] | |
| 839 630 | 6 428 | 832 923 | 0,77 % | 707 | [56] | |
| 806 591 | 29 896 | 722 296 | 3,71 % | 3 060 | [57] | |
| 822 849 | 13 032 | 761 916 | 1,58 % | 79 | [58],[59] | |
| 771 840 | 13 977 | 724 804 | 1,81 % | 111 | [60] | |
| 739 847 | 9 530 | 721 016 | 1,29 % | 914 | [61] | |
| 714 634 | 6 951 | – | 0,97 % | 990 | [62] | |
| 700 051 | 10 304 | 317 600 | 1,47 % | 1 217 | [63],[64] | |
| 648 387 | 10 656 | 633 538 | 1,64 % | 1 210 | [65] | |
| 652 204 | 3 844 | 572 113 | 0,59 % | 122 | [66] | |
| 596 017 | 1 724 | 575 288 | 0,29 % | 183 | [67] | |
| 606 778 | 8 366 | 527 111 | 1,38 % | 276 | [68] | |
| 542 375 | 7 790 | 526 598 | 1,44 % | 1 277 | [69] | |
| 523 165 | 9 202 | 510 623 | 1,76 % | 255 | [70] | |
| 463 703 | 7 537 | 446 054 | 1,63 % | 228 | [71] | |
| 437 121 | 20 997 | 398 645 | 4,8 % | 1 263 | [72],[73] | |
| 420 213 | 17 893 | 389 368 | 4,26 % | 2 556 | [74],[75] | |
| 413 170 | 12 370 | data-sort-value="−1" | 2,99 % | 1 150 | [76] | |
| 403 845 | 2 958 | 396 650 | 0,73 % | 316 | [77] | |
| 390 984 | 12 436 | – | 3,18 % | 2 304 | [78] | |
| 397 976 | 4 124 | 372 414 | 1,04 % | 226 | [79],[80] | |
| 386 269 | 6 427 | 371 015 | 1,66 % | 1 568 | [81] | |
| 400 047 | 15 321 | 315 304 | 3,83 % | 1 386 | [82] | |
| 358 504 | 8 132 | 349 244 | 2,27 % | 1 981 | [83] | |
| 387 687 | 10 561 | 319 572 | 2,72 % | 1 551 | [84] | |
| 364 819 | 13 365 | 319 475 | 3,66 % | 1 156 | [85] | |
| 353 443 | 5 034 | 338 318 | 1,42 % | 1 354 | [86] | |
| 335 065 | 4 951 | 328 194 | 1,48 % | 489 | [87] | |
| 339 900 | 4 322 | 261 195 | 1,27 % | 881 | [88] | |
| 325 014 | 1 813 | 307 512 | 0,56 % | 394 | [89] | |
| 333 484 | 4 906 | 293 332 | 1,47 % | 1 419 | [90],[91] | |
| 306 698 | 3 700 | 249 637 | 1,21 % | 356 | [92] | |
| 289 559 | 2 525 | 277 448 | 0,87 % | 441 | [93],[94] | |
| 277 623 | 4 335 | 263 216 | 1,56 % | 1 553 | [95],[96] | |
| 273 892 | 4 235 | 249 471 | 1,55 % | 40 | [97] | |
| 271 780 | 15 547 | 199 840 | 5,72 % | 164 | [98] | |
| 263 720 | 4 941 | – | 1,87 % | 1 038 | [99] | |
| 255 715 | 6 149 | 248 501 | 2,4 % | 2 411 | [100] | |
| 269 308 | 8 416 | 244 416 | 3,13 % | 488 | [101] | |
| 256 224 | 4 398 | – | 1,72 % | 2 128 | [102],[103] | |
| 245 695 | 6 599 | 87 864 | 2,69 % | 712 | [104],[105] | |
| 255 954 | 1 188 | 238 540 | 0,46 % | 796 | [106] | |
| 247 847 | 2 781 | 227 699 | 1,12 % | 98 | [107] | |
| 223 643 | 4 482 | 215 118 | 2 % | 1 529 | [108] | |
| 219 466 | 574 | 216 483 | 0,26 % | 217 | [109] | |
| 230 219 | 2 467 | 207 799 | 1,07 % | 511 | [110] | |
| 204 597 | 9 479 | 177 122 | 4,63 % | 2 703 | [111] | |
| 218 923 | 2 073 | 184 090 | 0,95 % | 97 | [112],[113] | |
| 188 386 | 3 155 | 174 223 | 1,67 % | 472 | [114] | |
| 174 773 | 3 378 | 119 589 | 1,93 % | 70 | [115] | |
| 167 051 | 2 117 | 163 430 | 1,27 % | 11 | [116] | |
| 193 105 | 1 431 | 150 271 | 0,74 % | 22 | [117],[118] | |
| 155 487 | 5 468 | 149 582 | 3,52 % | 2 635 | [119] | |
| 145 064 | 3 239 | 132 765 | 2,23 % | 61 | [120] | |
| 153 578 | 1 057 | 146 418 | 0,69 % | 92 | [121],[122] | |
| 147 422 | 1 982 | 138 037 | 1,34 % | 39 | [123],[124] | |
| 135 940 | 2 451 | 130 548 | 1,8 % | 1 284 | [125],[126] | |
| 132 437 | 2 453 | 129 807 | 1,85 % | 812 | [127],[128] | |
| 130 473 | 1 266 | 125 715 | 0,97 % | 956 | [129],[130] | |
| 132 355 | 3 552 | 92 132 | 2,68 % | 86 | [131] | |
| 127 874 | 789 | 88 952 | 0,62 % | 146 | [132] | |
| 107 554 | 2 248 | 104 795 | 2,09 % | 1 194 | [133] | |
| 109 812 | 1 881 | 102 314 | 1,71 % | 303 | [134] | |
| 102 892 | 704 | 98 923 | 0,68 % | 21 | [135] | |
| 99 914 | 1 597 | 97 844 | 1,6 % | 2 566 | [136] | |
| 107 974 | 1 348 | 95 674 | 1,25 % | 79 | [137] | |
| 94 444 | 789 | 92 552 | 0,84 % | 29 | [138] | |
| 93 774 | 964 | 31 000 | 1,03 % | 175 | [139],[140] | |
| 91 394 | 4 636 | 86 312 | 5,07 % | 3 | [141] | |
| 79 904 | 1 302 | 57 008 | 1,63 % | 54 | [142],[143] | |
| 75 351 | 2 288 | 70 150 | 3,04 % | 356 | [144] | |
| 72 750 | 363 | – | 0,5 % | 318 | [145] | |
| 89 861 | 3 527 | 60 948 | 3,92 % | 96 | [146] | |
| 71 355 | 840 | 69 878 | 1,18 % | 28 | [147],[148] | |
| 70 406 | 818 | 68 943 | 1,16 % | 1 306 | [149] | |
| 67 538 | 182 | 46 334 | 0,27 % | 417 | [150] | |
| 62 223 | 34 | 61 740 | 0,05 % | 6 | [151] | |
| 72 104 | 342 | 56 253 | 0,47 % | 111 | [152] | |
| 61 374 | 968 | 53 143 | 1,58 % | 382 | [153] | |
| 55 542 | 885 | 53 887 | 1,59 % | 386 | [154] | |
| 49 110 | 989 | 27 013 | 2,01 % | 342 | [155],[156] | |
| 47 476 | 306 | 46 941 | 0,64 % | 13 | [157],[158] | |
| 58 515 | 408 | 47 760 | 0,7 % | 10 | [159],[160] | |
| 41 680 | 1 148 | 40 298 | 2,75 % | 72 | [161] | |
| 41 840 | 875 | 40 676 | 2,09 % | 34 | [162],[163] | |
| 39 496 | 1 626 | 36 940 | 4,12 % | 98 | [164] | |
| 36 203 | 2 719 | 29 841 | 7,51 % | 67 | [165] | |
| 36 285 | 815 | 29 960 | 2,25 % | 27 | [166] | |
| 34 470 | 1 158 | 32 709 | 3,36 % | 62 | [167] | |
| 34 694 | 831 | 27 823 | 2,4 % | 10 | [168],[169] | |
| 37 321 | 311 | 30 617 | 0,83 % | 19 | [170],[171] | |
| 30 581 | 419 | 30 100 | 1,37 % | 901 | [172] | |
| 31 512 | 272 | 30 231 | 0,86 % | 498 | [173] | |
| 30 229 | 910 | – | 3,01 % | 37 | [174] | |
| 27 660 | 366 | 26 341 | 1,32 % | 30 | [175],[176] | |
| 24 743 | 1 804 | 21 658 | 7,29 % | 98 | [177] | |
| 24 736 | 156 | 23 736 | 0,63 % | 77 | [178] | |
| 28 106 | 644 | 18 009 | 2,29 % | 470 | [179],[180] | |
| 23 366 | 167 | 21 438 | 0,71 % | 13 | [181] | |
| 19 959 | 472 | 19 005 | 2,36 % | 107 | [182],[183] | |
| 18 705 | 676 | 17 923 | 3,61 % | 601 | [184] | |
| 18 088 | 419 | 16 042 | 2,32 % | 539 | [185] | |
| 16 621 | 164 | 15 942 | 0,99 % | 18 | [186] | |
| 17 799 | 390 | 13 664 | 2,19 % | 692 | [187] | |
| 14 776 | 773 | 6 985 | 5,23 % | 70 | [188] | |
| 15 908 | 333 | 12 557 | 2,09 % | 30 | [189] | |
| 14 298 | 519 | 9 873 | 3,63 % | 28 | [190] | |
| 13 813 | 127 | 13 591 | 0,92 % | 1 667 | [191] | |
| 13 714 | 90 | 13 218 | 0,66 % | 10 | [192],[193] | |
| 13 597 | 126 | 13 294 | 0,93 % | 16 | [194] | |
| 13 452 | 167 | 13 265 | 1,24 % | 9 | [195],[196] | |
| 12 924 | 325 | 12 460 | 2,51 % | 867 | [197] | |
| 11 875 | 210 | 11 561 | 1,77 % | 28 | [198] | |
| 11 930 | 232 | 10 932 | 1,94 % | 587 | [199] | |
| 11 920 | 155 | 8 208 | 1,3 % | 29 | [200],[201] | |
| 12 973 | 46 | 11 634 | 0,35 % | 480 | [202],[203] | |
| 11 562 | 154 | 11 385 | 1,33 % | 161 | [204] | |
| 10 853 | 326 | 6 440 | 3 % | 146 | [205] | |
| 10 688 | 115 | 10 514 | 1,08 % | 9 | [206] | |
| 8 640 | 118 | 8 303 | 1,37 % | 93 | [207] | |
| 12 746 | 411 | No data | 3,22 % | 17 | [208] | |
| 8 109 | 102 | 7 979 | 1,26 % | 9 | [209] | |
| 7 662 | 188 | – | 2,45 % | 30 | [210] | |
| 10 137 | 58 | 3 804 | 0,57 % | 1 | [211] | |
| 7 101 | 98 | 5 112 | 1,38 % | 21 | [212],[213] | |
| 7 764 | 17 | 5 515 | 0,22 % | 13 | [214] | |
| 6 856 | 1 342 | 3 697 | 19,57 % | 48 | [215] | |
| 6 616 | 30 | 6 543 | 0,45 % | 84 | [216] | |
| 6 002 | 179 | 5 800 | 2,98 % | 85 | [217] | |
| 5 438 | 192 | 5 131 | 3,53 % | 9 | [218],[219] | |
| 5 090 | 90 | 4 998 | 1,77 % | 2 695 | [220] | |
| 5 168 | 80 | 4 968 | 1,55 % | 447 | [221] | |
| 4 939 | 174 | 4 754 | 3,52 % | 11 | [222],[223] | |
| 4 975 | 8 | 773 | 0,16 % | 1 | [224] | |
| 4 289 | 79 | 3 166 | 1,84 % | 10 | [225] | |
| 4 848 | 16 | 4 278 | 0,33 % | 5 | [226] | |
| 3 890 | 146 | 3 736 | 3,75 % | 177 | [227] | |
| 3 787 | 68 | 3 533 | 1,8 % | 37 | [228],[229] | |
| 3 026 | 59 | 2 948 | 1,95 % | 1 556 | [230] | |
| 2 520 | 33 | 2 473 | 1,31 % | 853 | [231] | |
| 2 356 | 37 | 2 307 | 1,57 % | 181 | [232] | |
| 2 346 | 26 | 2 291 | 1,11 % | 5 | [233],[234] | |
| 2 484 | 93 | 2 065 | 3,74 % | 20 | [235] | |
| 1 990 | 3 | 1 859 | 0,15 % | 0 | [236] | |
| 1 789 | 1 | 1 440 | 0,06 % | 1 | [237] | |
| 1 566 | 18 | 1 243 | 1,15 % | 14 | [238] | |
| 1 263 | 42 | 1 218 | 3,33 % | 412 | [239] | |
| 712 | 14 | 698 | 1,97 % | 3 773 | [240],[241] | |
| – | – | – | – | – | [242],[243] | |
| 970 | 4 | 278 | 0,41 % | 4 | [244] | |
| 248 | 3 | 239 | 1,21 % | 7 | [245],[246] | |
| 236 | 7 | 218 | 2,97 % | 24 | [247] | |
| 189 | 0 | 188 | 0 % | 0 | [248] | |
| 160 | 1 | 158 | 0,63 % | 9 | [249] | |
| 98 | 0 | 81 | 0 % | 0 | [250],[251] | |
| 119 | 0 | 58 | 0 % | 0 | [252],[253] | |
| 52 | 0 | 51 | 0 % | 0 | [254] | |
| 29 | 0 | 27 | 0 % | 0 | [255],[256] | |
| 28 | 2 | 26 | 0 % | 0 | [257] | |
| 13 | 0 | 4 | 0 % | 0 | [258] | |
| 13 | 4 | – | 30,77 % | 2 187 | [259],[260] | |
| 4 | 0 | 0 | 0 % | 0 | [261] | |
| 3 | 0 | 1 | 0 % | 0 | [262],[263] | |
| 3 | 0 | 3 | 0 % | 0 | [264],[265] | |
| 1 | 0 | 0 | 0 % | 0 | [266] |
Caractérisation
La taxonomie de ces nouveaux virus fait d'abord débat, pour finalement aboutir en 1975 à la création d'une nouvelle famille (Coronaviridae) et d'une nouvelle sous-famille (Orthocoronavirinae) par l'International Committee on Taxonomy of Viruses[10].
Dénomination
Le terme coronavirus (du latin corona et virus, littéralement « virus à couronne »[267]) provient de l'apparence des virions au microscope électronique, caractérisée par une frange de grandes protubérances entourant l'enveloppe avec l'apparence d'une couronne, par analogie avec la couronne solaire[2].
Hôtes du virus
Les hôtes idéaux des coronavirus, en tant que vertébrés volants à sang chaud, sont les chauves-souris (pour les Alphacoronavirus et les Betacoronavirus) et les oiseaux (pour les Gammacoronavirus et les Deltacoronavirus). Ces espèces-réservoir assurent l'évolution et la dissémination des coronavirus[5]. Chez d'autres espèces, les symptômes varient (maladies des voies respiratoires supérieures chez la poule, diarrhée chez la vache ou le porc, des voies digestives chez le chat et le chien, etc.). Parfois, aucun symptôme n'est associé à leur présence (ex. coronavirus du béluga).
L'être humain abrite naturellement quatre types de coronavirus bénins, qui provoquent des infections des voies respiratoires, comme le rhume, et plus rarement affectent les systèmes gastro-intestinaux, cardiaques et nerveux[268].
Les groupes de coronavirus ont normalement un hôte animal spécifique (mammifères ou oiseaux[269]) mais ils peuvent parfois changer d'hôte à la suite d'une mutation. Ce sont de telles mutations qui ont probablement conduit à l'apparition de souches causant de graves infections chez l'homme (SRAS, MERS et Covid-19).
Tropisme
On a longtemps pensé que les coronavirus avaient un tropisme uniquement respiratoire ou gastrointestinal (traduit par des pneumonies et entérocolites dans les cas graves), mais un nombre croissant d'études montrent un tropisme bien plus large, cardiovasculaire notamment, et neurologique également (dès les années 1980, on a montré que plusieurs coronavirus, dont en dernier cas le SARS-CoV-2 sont clairement aussi neuroinvasifs et neurotropes[270],[271],[272], au point que cette diversité de tropismes et de symptômes font des coronavirus (murins notamment, regroupées sous le sigle de MHV) un modèle animal pour l'étude de maladies humaines aussi variées que la sclérose en plaques, l’hépatite virale ou la pneumonie (S. R. Weiss et al. 2011). Le MHV pénètre le Système nerveux central (SNC) via les neurones du nerf olfactif, et peut causer une encéphalite aiguë ou une maladie démyélinisante chronique s'il y persiste (il peut aussi se propager jusqu’à la moelle épinière)[271],[273].
Recherches
En 2002, l’apparition du Sars-CoV, un virus responsable d'une maladie infectieuse des poumons, pousse l’Union européenne à lancer plusieurs programmes afin de ne pas être prise au dépourvu en cas de nouvelles émergences. Dès 2004, l’équipe de Bruno Canard, directeur de recherche CNRS à Aix-Marseille, spécialiste des coronavirus, grâce aux réseaux collaboratifs européens, affiche des résultats prometteurs. « Nous avions eu cette idée qui s’est révélée fructueuse : les virus ont une capacité énorme à être différents, variés, avec de larges familles. Nous les avons donc étudiés tous en même temps, afin d’en avoir un modèle type qui nous permettrait, en cas de menace d’un virus inconnu, d’en trouver un proche, d’où nous pourrions extraire des données scientifiques.[274] ».
Mais dès 2006, l’intérêt des politiques pour le Sars-CoV disparait. La crise financière de 2008 accélère le désengagement de l’Europe et de la France pour la recherche, les stratégies de recherche fondamentale perdent leurs financements. Aussi, en 2015, Bruno Canard, dénonce le désengagement européen et français dans le secteur des sciences et adresse avec ses collègues belges et hollandais des lettres d’intention à la Commission européenne, où il explique qu’il existe neuf familles de virus pour lesquelles une émergence est possible. « Le premier sur la liste était le flavivirus, explique-t-il. Le second, le coronavirus. Un an plus tard, apparaissait Zika, un flavivirus ». Or La Commission européenne ne donnera jamais de réponse. Et en 2020 surgit le Sars-CoV-2, un coronavirus[274] engendrant la Covid-19.
Biologie
Morphologie
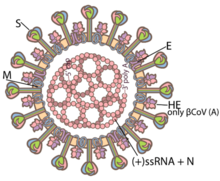
Ce virus enveloppé est constitué d'une enveloppe virale entourant une capside hélicoïdale qui contient le brin d'ARN. La taille du génome de ces virus varie d'environ 26 à 32 kilobases, valeurs parmi les plus élevées chez les virus à ARN.
Les coronavirus ont en commun des protéines désignées par une lettre indiquant leur localisation : S (protubérances), E (enveloppe), M (membrane) et N (nucléocapside). Certains, notamment ceux du sous-groupe A du genre Betacoronavirus, ont une protéine HE (hémagglutinine estérase (en)) caractéristique. Le coronavirus du SRAS présente en outre sur la protéine S un site de liaison spécifique à l'enzyme de conversion de l'angiotensine 2[275] qui lui sert de point d'entrée dans la cellule hôte.
La taille physique du virion est classiquement donnée comme étant de 120 à 160 nm[276] ou comme étant de l'ordre de 125 nm[277]. Toutefois le SARS-CoV-2, responsable de la Covid-19 a été annoncé plus récemment comme mesurant approximativement de 60 à 140 nm, et comme étant de forme elliptique avec de nombreuses variations[278].
Génome
Tous les CoV ont un génome d'ARN non-segmentés (simple brin) organisé de la même manière : les deux tiers environ du génome contiennent deux grands « cadres de lecture ouverts » et se chevauchant (dits ORF1a et ORF1b). Ces deux cadres sont traduits en « polyprotéines réplicase » pp1a et pp1ab. « Ces polyprotéines sont ensuite traitées pour générer 16 protéines non structurales, désignées nsp1 ~ 16. La partie restante du génome contient des ORF pour les protéines structurales, y compris la pointe (S), l'enveloppe (E), la membrane (M) et la nucléoprotéine (N). Un certain nombre de protéines accessoires spécifiques à la lignée sont également codées par différentes lignées de CoV »[3],[279],[280],[281].
Réplication
Elle se fait en six étapes successives (voir illustration) :
- grâce à leur protéine S, les coronavirus se lient aux molécules cellulaires de surface telles que les métalloprotéinases. Les virus dotés en plus de la protéine HE (hémagglutinine-estérase) dans leur enveloppe peuvent aussi se lier à l'acide N-acétylneuraminique qui sert de corécepteur (lui-même initiateur de l'entrée d'un pathogène dans une cellule hôte). On ne sait pas clairement si les virus entrent dans la cellule hôte par fusion des membranes virales et cellulaires, ou par une internalisation à récepteur. Quel qu’en soit le mécanisme, le brin d'ARN est inséré dans la cellule, et la capside (la coque) est abandonnée ;
- les coronavirus sont munis d'un seul génome ARN à brin positif, à présent sur place dans le cytoplasme. Le génome de l'ARN du coronavirus a une coiffe méthylée 5' et une queue polyadénylée 3', ce qui permet à l'ARN de se fixer aux ribosomes pour la traduction. Les ribosomes de la cellule décodent l'ARN viral, produisant les protéines qui y sont codées ;
- d'abord l'ARN positif du virus est transcrit en protéine pour former une ARN polymérase propre (une ARN polymérase ARN-dépendante). La réplicase est la première protéine fabriquée ; une fois le gène codant la réplicase traduit par le ribosome de la cellule hôte, la traduction est arrêtée par un codon stop. Cette réplicase virale ne reconnaît et produit que l'ARN viral, et permet au génome viral d'être transcrit en nouvelles copies d'ARN, à l'aide de la machinerie de la cellule hôte. Se servant du brin positif comme modèle, cet enzyme assemble le brin négatif ;
- par la suite, ce brin négatif sert lui-même de modèle pour transcrire de petits ARN sous-génomiques, qui sont utilisés pour fabriquer toutes les autres protéines. C'est ce qu'on appelle une transcription imbriquée. Ce processus est une forme d'économie génétique, permettant au virus de coder le plus grand nombre de gènes dans un petit nombre de nucléotides ;
le génome du brin négatif est traduit par le ribosome de la cellule hôte, et une longue polyprotéine est formée, où toutes les protéines virales sont attachées. Les coronavirus ont une protéine non structurale — une protéase — qui est capable de cliver la polyprotéine.
Par ailleurs, ce brin négatif joue un rôle dans la réplication de nouveaux génomes ARN à brin positif.
Le cytoplasme de la cellule hôte se remplit de protéines et d'ARN viraux ; - (a) la protéine N aide à lier l'ARN génomique pour réaliser l’encapsidation du génome virale dans une enveloppe protectrice nommée capside[282] ; la protéine M s'intègre à la membrane du réticulum endoplasmique, côté capside ; et des protéines HE et S traversent la membrane du réticulum endoplasmique, via la protéine de translocation, et se positionnent du côté opposé ;
(b) avec la liaison entre la capside et les protéines M, la membrane du réticulum s'invagine, et bourgeonne. La capside (la coque) assemblée dotée d'ARN hélicoïdal se retrouve alors à l'intérieur du réticulum endoplasmique, ayant capturé à son profit la membrane de ce dernier, qui porte à présent à son extérieur les protéines HE et S ; - cette progéniture virale est ensuite (a) encapsulée et transportée par des vésicules golgiennes vers la membrane cellulaire, (b) pour être enfin externalisée (par exocytose) hors de la cellule.
Types d'infection
Sept types de coronavirus infectent couramment l'homme[283], dont trois causent des infections graves.
Infections bénignes
Les quatre premiers types connus sont sans gravité : les coronavirus humains 229E, NL63, OC43 et HKU1, inconnus chez la chauve-souris. Ils causent des rhumes avec fièvre et des maux de gorge dus à des végétations adénoïdes gonflées, principalement en hiver et au début du printemps[284].
Les coronavirus seraient la cause de 15 à 30 % des rhumes courants[285].
Infections graves
Trois types de coronavirus qui ne se trouvent pas naturellement chez l'homme mais chez des mammifères ont été découverts plus récemment et ont été à l'origine d'infections graves des poumons (pneumopathie virale) :
- le SARS-CoV, agent pathogène du syndrome respiratoire aigu sévère (SRAS) dont l'épidémie de 2002-2004 a déclenché une alerte mondiale de l'OMS. Elle a débuté en Chine après la consommation dans un restaurant d'un animal sauvage, la civette palmiste masquée. La maladie a fait 774 morts (10 % environ des personnes atteintes). Elle est considérée comme éradiquée depuis 2004 ;
- le MERS-CoV, celui du syndrome respiratoire du Moyen-Orient dont la première épidémie a débuté en Arabie saoudite en 2012. Son taux de mortalité a été de 35 %, faisant [Quand ?]449 victimes seulement du fait du faible nombre d'individus atteints. [réf. nécessaire]Elle aurait été déclenchée par la consommation de lait de chameau et par la proximité avec les chameaux. Cette maladie existe toujours car pour pouvoir l'éradiquer, il faudrait que les populations qui utilisent traditionnellement des chameaux puissent s'en passer ;
- le SARS-CoV-2, celui de la maladie à coronavirus 2019 (Covid-19) apparue en Chine en 2019 et responsable d'une sévère pandémie en 2020. La consommation de viande de pangolin[286] et de chauve-souris (vendues pour l'alimentation en Chine) pourrait en être à l'origine.
Selon le virus en cause, les formes graves de la maladie ont leurs particularités. Par exemple, la diarrhée était très fréquente dans le SRAS mais rare dans la maladie à coronavirus 2019.
Comparaison des infections graves
Trois principales sources sont utilisées : l'Institut Pasteur, l'OMS et les CDC américains[287].
| Syndrome respiratoire du Moyen-Orient (MERS)[288],[289] | Syndrome respiratoire aigu sévère (SRAS)[290],[291],[292] | Maladie à coronavirus 2019 (COVID-19) | |
|---|---|---|---|
| Agent pathogène | MERS-CoV | SARS-CoV | SARS-CoV-2 |
| Année d'apparition | 2012 | 2003 | 2019 |
| Nombre de cas | 1 219 | 8 098 dont 5 327 en Chine. | En cours, voir ici |
| Pourcentage de cas par transmission nosocomiale | 70 %[293] | 58 %[293] | |
| Nombre de décès | 449 | 774 (dont 349 en Chine) | En cours, voir ici |
| Réservoir | Dromadaire | Chauve-souris | Chauve-souris (probablement) |
| Transmission à l'homme par l'animal | Contact direct avec un animal infecté, consommation de lait cru de dromadaire. | Consommation de viande de civette palmiste masquée, animal sauvage vendu sur les marchés et consommé dans le Sud de la Chine. | Un pangolin[286] pourrait être l'hôte intermédiaire. |
| Transmission interhumaine | Oui | Oui | Oui |
| Transmission par objet | – | Oui | Risque très faible. |
| Transmission materno-fœtale | – | Aucun cas retrouvé chez les femmes enceintes infectées par ce virus[294]. | Aucune preuve[295]. |
| Transmission par le lait maternel | Un seul cas documenté[296] | RT-PCR négative sur 16 femmes testées[297] | |
| Incubation | Entre 5 et 15 jours. | Entre 2 et 7 jours. | Durée médiane d'incubation à 5,1 jours (5,5 jours en moyenne), 97,5 % des personnes seront malades 11,5 jours après le contact infectieux[298]. |
| Porteur sain | – | Probablement pas. | Oui, (un seul cas publié) |
| Contagiosité | Taux de reproduction inférieur à 1[299]. | Taux de reproduction supérieur à 2[299]. | Médiane du taux de reproduction de base (R0) à 2,79[300]. |
| Durée de la contagiosité | – | – | Semble limitée à la période des signes cliniques. Possibilité disputée de contagion en phase asymptomatique[301]. |
| Début de la période de contagiosité | – | 3 à 4 jours après le début des signes cliniques. | Dès l'apparition des signes cliniques. Porteur asymptomatique prouvé[302]. |
| Fièvre | À 98% | À 99% | À 87.9%, mais peut apparaître plusieurs jours après la toux ou les difficultés à respirer. |
| Diarrhée | À 26% | À 20%[294]. | À 3.7%. |
| Transmission par les selles | Très probable mais a joué un rôle mineur[294]. | Cette possibilité est envisagée[303]. | |
| Létalité | 34,4 %[293] | 9,5 %[293], au-delà de 50 % chez les plus de 65 ans. | 3,4 %[304] |
| Traitement | Symptomatique | Symptomatique | Symptomatique |
| Vaccin | Aucun | Aucun | En cours |
| Statut | Résurgence possible. | Considéré comme éradiqué. | Épidémie en cours. |
Passage de la barrière des espèces
Au vu des séquences génomiques disponibles, deux grands taxons animaux seraient le réservoir principal des CoVs :
- chiroptères : hôtes naturels du HCoV-NL63 et du HCoV-229E[305] ;
- rongeurs : hôtes naturels du HCoV-OC43 et HKU1[305].
Au vu des connaissances disponibles, les coronavirus semblaient avoir besoin d'hôtes intermédiaires (toujours des mammifères) pour s'« humaniser », c'est-à-dire muter pour pouvoir infecter l'Homme.
Des hôtes intermédiaires connus ont été :
- des bovins pour HCoV-OC43[305]
- l'alpaga pour HCoV-229E[305]
- la civette masquée pour le SARS-CoV[305]
- le dromadaire pour le MERS-CoV[305]
Transmission interhumaine
Pour la pandémie de 2019-2020, se reporter aux articles dont les noms suivent.
La transmission interhumaine des coronavirus se fait principalement par les gouttelettes ou des aérosols respiratoires expectorées par une personne infectée (via la toux, les éternuements, des postillons, ou parfois par le simple fait de parler fort ou en criant) quand les particules virales sont inhalées par une personne se trouve à proximité. La transmission et la contagiosité varient aussi selon le coronavirus, et peut-être selon sa souche au sein d'une épidémie.
La prophylaxie passe par une prévention primaire visant à limiter la transmission du virus : éviter les contacts (surfaces potentiellement contaminées, poignées de main, embrassades), se laver les mains fréquemment, éviter de se toucher les yeux, le nez ou la bouche, par où le virus peut s'introduire dans l'organisme. En cas de symptômes de type toux ou rhume, se maintenir à au moins 1 mètre de toute personne et éviter d'émettre des particules contaminées[306].
D'autres recommandations comprennent[307] :
- ne pas entrer en contact avec des animaux manifestement malades, ne pas consommer de viandes provenant d'animaux malades ;
- ne pas consommer de produits animaux (viande...) mal cuits, ni de légumes crus s'ils n'ont pas été lavés avec de l'eau non contaminée.
Traitement
Dans le cas du SRAS, des médicaments ont été utilisés pour tenter d'enrayer l'épidémie : la ribavirine, un analogue de nucléotides, des anti-inflammatoires stéroïdiens et, après identification formelle de l'agent pathogène et des criblages de sensibilité, l'interféron-alpha et des inhibiteurs de protéases. Leur efficacité est encore sujette à caution. Aucun n'a fait l'objet d'une étude clinique adéquate : beaucoup d'études disponibles ne permettent pas de conclusions scientifiques claires car elles ont été réalisées sur de petits nombres de sujets ou alors sans protocole ou dose fixe. Certaines indiquent même que ces traitements pourraient avoir nui à l'éradication du virus[308].
Bruno Canard dénonce en mars 2020 l'emballement et publie une lettre ouverte Coronavirus : la science ne marche pas dans l’urgence ![309]. Il déclare : « Un vaccin demande au mieux 18 mois de recherches. Et pour des virus non prévisibles, qui changent, il n’est pas adapté. Mieux vaut faire des médicaments qui ont un large spectre dans une famille virale. Cela peut nécessiter 5 ans, parfois 10. D’où l’importance de l’anticipation scientifique[274]. ».
Vaccins
L'éradication rapide de l'épidémie de SRAS précédente n'a pas laissé place à beaucoup d'essais cliniques. Des vaccins à base de virus inactivé, et d'autres fondés sur les protéines S et N, sont à l'étude depuis plusieurs années[310]. Pour les vaccins, les éléments viraux produisant l'immunité ne sont souvent pas assez conservés dans la même famille virale. "Ainsi, s'il y avait eu un vaccin contre le coronavirus de 2003, il est pratiquement certain qu'il n'aurait pas marché de manière satisfaisante contre le Covid-19" (Bruno Canard)[311].
Taxonomie
Les coronavirus sont nommés par un groupe d'étude[312] travaillant au sein de l'ICTV (International committee on Taxonomy of viruses)[313].
Classification
Les coronavirus (CoV) sont des virus à ARN monocaténaire de sens positif (groupe IV de la classification Baltimore) correspondant à la sous-famille Orthocoronavirinae de la taxonomie de l'ICTV[1], dans la famille Coronaviridae, et de l'ordre Nidovirales[314],[315].
Selon les caractéristiques de leurs séquences protéiques, les CoV sont classés en 4 genres (alpha-CoV, beta-CoV, gamma-CoV et delta-CoV), qui tous contiennent des virus pathogènes pour les mammifères[4] :
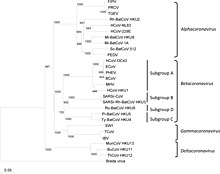
- Alphacoronavirus, qui inclut le virus de la diarrhée épidémique porcine (PEDv), le virus de la gastro-entérite transmissible porcine (TGEV), le coronavirus du syndrome de la diarrhée aiguë porcine (SADS-CoV), le coronavirus canin, le coronavirus entérique félin, le virus de la péritonite infectieuse féline (FIPV) ;
- Betacoronavirus, dont le virus respiratoire-respiratoire du SRAS (SARS-CoV), le SARS-CoV-2, le coronavirus du syndrome respiratoire du Moyen-Orient (MERS-CoV), virus de l'hépatite murine (MHV), coronavirus bovins, virus de la sialodacryoadénite du rat, virus de la sialodacryoadénite porcine, hémagglutinose porcine, virus de l'hémagglutinose porcine coronavirus équin. Dans ce genre Betacoronavirus, le SARS-CoV et le SARS-CoV-2 appartiennent tous les deux au sous-genre Sarbecovirus au sein duquel trois clades distincts ont été identifiés :
- Clade1: souches "chauve-souris" de Bulgarie et Kenya[316] ;
- Clade2: SARS-CoV-2 et souches "chauve-souris" de Chine orientale[316] ;
- Clade3: SARS-CoV et souches "chauves-souris" de Chine du sud-ouest[316] : - Gammacoronavirus: surtout trouvé chez des oiseaux migrateurs, causant notamment des bronchites ; un Gammacoronavirus a été isolé d'un béluga en captivité,
- Deltacoronavirus: connus depuis peu, qui semblent surtout infecter les oiseaux, mais aussi trouvé chez les porcs.
Remarques :
- On a parfois nommé un coronavirus selon l'espèce animale où il a d'abord été trouvé (par exemple : coronavirus respiratoire canin, ou CRCoV pour Canine respiratory coronavirus, virus appartenant au genre betacoronavirus et à son sous-groupe 2a)[317],[318].
- Le dernier coronavirus trouvé, en 2019, est le SARS-CoV-2, responsable de la pandémie de Covid-19.
Liste des espèces
La sous-famille Orthocoronavirinae de la famille Coronaviridae est organisée en 4 genres, 22 sous-genres et une quarantaine d'espèces[319] :
- Sous-famille Orthocoronavirinae
- Genre Alphacoronavirus
- Sous-genre Colacovirus
- Bat coronavirus CDPHE15
- Sous-genre Decacovirus
- Bat coronavirus HKU10
- Rhinolophus ferrumequinum alphacoronavirus HuB-2013
- Sous-genre Duvinacovirus
- Human coronavirus 229E (HCoV-229E)
- Sous-genre Luchacovirus
- Lucheng Rn rat coronavirus
- Sous-genre Minacovirus
- Ferret coronavirus
- Mink coronavirus 1
- Sous-genre Minunacovirus
- Miniopterus bat coronavirus 1
- Miniopterus bat coronavirus HKU8
- Sous-genre Myotacovirus
- Myotis ricketti alphacoronavirus Sax-2011
- Nyctacovirus
- Nyctalus velutinus alphacoronavirus SC-2013
- Sous-genre Pedacovirus
- Porcine epidemic diarrhea virus
- Scotophilus bat coronavirus 512
- Sous-genre Rhinacovirus
- Rhinolophus bat coronavirus HKU2
- SADS-CoV (Coronavirus du syndrome de la diarrhée aiguë porcine)
- Rhinolophus bat coronavirus HKU2
- Sous-genre Setracovirus
- Human coronavirus NL63 (HCoV-NL63)
- NL63-related bat coronavirus strain BtKYNL63-9b
- Sous-genre Tegacovirus
- Alphacoronavirus 1
- Sous-genre Colacovirus
- Genre Betacoronavirus
- Sous-genre Embecovirus
- Betacoronavirus 1
- HCoV-OC43
- Bovine coronavirus
- Canine respiratory coronavirus
- Coronavirus HKU23
- Equine coronavirus
- Porcine hemagglutinating encephalomyelitis virus
- Yak coronavirus
- China Rattus coronavirus HKU24
- Human coronavirus HKU1 (HCoV-HKU1)
- Murine coronavirus
- Myodes coronavirus 2JL14
- Betacoronavirus 1
- Sous-genre Hibecovirus
- Bat Hp-betacoronavirus Zhejiang2013
- Sous-genre Merbecovirus
- Hedgehog coronavirus 1
- Middle East respiratory syndrome-related coronavirus (MERS-CoV)
- Pipistrellus bat coronavirus HKU5
- Tylonycteris bat coronavirus HKU4
- Sous-genre Nobecovirus
- Rousettus bat coronavirus GCCDC1
- Rousettus bat coronavirus HKU9
- Sous-genre Sarbecovirus
- Severe acute respiratory syndrome-related coronavirus (SARSr-CoV)
- SARS-CoV (humain; SRAS)
- SARSr-CoV WIV1 (chauve-souris)
- SARSr-CoV HKU3 (chauve-souris)
- SARSr-CoV RP3 (chauve-souris)
- SARS-CoV-2 (humain; Covid-19)
- Severe acute respiratory syndrome-related coronavirus (SARSr-CoV)
- Sous-genre Embecovirus
- Genre Gammacoronavirus
- Sous-genre Cegacovirus
- Beluga whale coronavirus SW1
- Sous-genre Igacovirus
- Sous-genre Cegacovirus
- Genre Deltacoronavirus
- Sous-genre Andecovirus
- Wigeon coronavirus HKU20
- Sous-genre Buldecovirus
- Bulbul coronavirus HKU11
- Coronavirus HKU15
- Munia coronavirus HKU13
- White-eye coronavirus HKU16
- Sous-genre Herdecovirus
- Night heron coronavirus HKU19
- Sous-genre Moordecovirus
- Common moorhen coronavirus HKU21
- Sous-genre Andecovirus
- Genre Alphacoronavirus
Notes
- Sont inclus les cas recensés à Porto Rico et aux îles Vierges des États-Unis.
- Sont inclus les cas recensés en Guadeloupe, en Guyane, à La Réunion, en Martinique, à Mayotte, en Nouvelle-Calédonie, en Polynésie française, à Saint-Barthélemy, à Saint-Martin et à Saint-Pierre-et-Miquelon.
- L'université Johns-Hopkins additionnant les cas confirmés et probables, les données de Santé publique France sont utilisées pour la France (source).
- Les chiffres ci-contre ne tiennent pas compte de la déclaration de la vice-première ministre en charge de la santé, Tatiana Golikova qui indiquait le 28 décembre que la COVID-19 aurait fait 186 000 morts depuis le début de la pandémie. Voir « Moscou admet que le nombre de morts du Covid-19 en Russie est trois fois supérieur au bilan officiel », sur Le Monde,
- Sont inclus les cas recensés à Anguilla, aux Bermudes, à Gibraltar, aux îles Anglo-Normandes, aux îles Caïmans, aux îles Turques-et-Caïques, aux îles Vierges britanniques, dans l'île de Man et à Montserrat.
- Sont inclus les cas recensés à Aruba, à Curaçao et à Saint-Martin.
- Le total des décès enregistrés au se répartissent comme suit: 57 % sont survenus en milieu hospitalier, 40 % en maisons de soins et de repos (sans test de confirmation), 1 % au domicile du patient et pour 2 %, l'information n'est pas disponible selon Sciensano.
- Sont inclus les cas recensés au Groenland et dans les îles Féroé.
Références
- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le 24 janvier 2020).
- (en) « Virology: Coronaviruses », Nature, vol. 220, no 5168, , p. 650–650 (ISSN 0028-0836 et 1476-4687, PMCID PMC7086490, DOI 10.1038/220650b0, lire en ligne, consulté le 14 mai 2020)
- (en) Zi-Wei Ye et Shuofeng Yuan, « Zoonotic origins of human coronaviruses », sur International Journal of Biological Sciences, (ISSN 1449-2288, PMID 32226286, PMCID PMC7098031, DOI 10.7150/ijbs.45472, consulté le 22 mai 2020), p. 1686–1697
- SARS-CoV, B.S (2020) Mutation and Recombination.
- (en) Patrick C. Y. Woo, Susanna K. P. Lau, Carol S. F. Lam, Candy C. Y. Lau, Alan K. L. Tsang, John H. N. Lau, Ru Bai, Jade L. L. Teng, Chris C. C. Tsang, Ming Wang, Bo-Jian Zheng, Kwok-Hung Chan et Kwok-Yung Yuen, « Discovery of Seven Novel Mammalian and Avian Coronaviruses in the Genus Deltacoronavirus Supports Bat Coronaviruses as the Gene Source of Alphacoronavirus and Betacoronavirus and Avian Coronaviruses as the Gene Source of Gammacoronavirus and Deltacoronavirus », Journal of Virology, vol. 86, no 7, , p. 3995-4008 (PMID 22278237, DOI 10.1128/JVI.06540-11, Bibcode 3302495, lire en ligne, consulté le 6 mars 2020)
- « Coronaviruses 101: Focus on Molecular Virology » (consulté le 2 avril 2020).
- (en-US) « Coronavirus | Human Coronavirus Types | CDC », sur www.cdc.gov, (consulté le 15 avril 2020)
- A. Z. Kapikian, « The coronaviruses », Developments in Biological Standardization, vol. 28, , p. 42–64 (ISSN 0301-5149, PMID 1092577, lire en ligne, consulté le 15 avril 2020)
- Cemal BULUT et Yasuyuki KATO, « Epidemiology of COVID-19 », TURKISH JOURNAL OF MEDICAL SCIENCES, vol. 50, no SI-1, , p. 563–570 (ISSN 1303-6165, DOI 10.3906/sag-2004-172, lire en ligne, consulté le 25 avril 2020)
- K McIntosh, W B Becker et R M Chanock, « Growth in suckling-mouse brain of "IBV-like" viruses from patients with upper respiratory tract disease. », Proceedings of the National Academy of Sciences of the United States of America, vol. 58, no 6, , p. 2268–2273 (ISSN 0027-8424, PMID 4298953, lire en ligne, consulté le 15 avril 2020)
- Steven Brocklehurst, « The woman who discovered the first coronavirus », sur https://www.bbc.com, British Broadcasting Corporation, (consulté le 17 avril 2020)
- (en) « COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU) », sur gisanddata.maps.arcgis.com (consulté le 14 juin 2020)
- « COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU) », sur ArcGIS, Johns Hopkins University (consulté le 12 juin 2021)
- « COVID-19/Coronavirus Real Time Updates With Credible Sources in US and Canada », sur 1point3acres (consulté le 11 juin 2021)
- « COVID-19 India », Ministry of Health and Family Welfare (India) 2021
- (pt) « Painel Coronavírus », Ministry of Health (Brazil) (consulté le 10 juin 2021)
- (pt-BR) « Brasil registra 2.693 novas mortes por Covid após feriado prolongado; casos passam de 17 milhões no total », G1, (consulté le 9 juin 2021)
- « info coronavirus covid-19 », Gouvernement.fr (consulté le 9 juin 2021)
- « COVID-19 : bilan et chiffres clés en France », www.santepubliquefrance.fr (consulté le 9 juin 2021)
- « Turkiye COVID-19 Hasta Tablosu », sur covid19.saglik.gov.tr (consulté le 11 juin 2021)
- (ru) « ru:Оперативные данные », sur Стопкоронавирус.рф (consulté le 12 juin 2021)
- « Coronavirus (COVID-19) in the UK », sur coronavirus.data.gov.uk (consulté le 11 juin 2021)
- (it) « COVID-19 ITALIA », sur opendatadpc.maps.arcgis.com, Protezione Civile (consulté le 11 juin 2021)
- (es) « Información epidemiológica », Ministerio de Salud (consulté le 11 juin 2021)
- (de) « Corona-Karte Deutschland: COVID-19 live in allen Landkreisen und Bundesländern », sur Tagesspiegel (consulté le 5 juin 2021)
- (de) « Wie sich das Coronavirus in Ihrer Region ausbreitet », Zeit Online (consulté le 5 juin 2021)
- (es) « La pandemia del coronavirus, en datos, mapas y gráficos », sur RTVE (consulté le 11 juin 2021)
- « CORONAVIRUS COLOMBIA », sur Instituto Nacional De Salud, (consulté le 11 juin 2021)
- (en) « Iran's COVID-19 cases surpass 3 mln », Xinhuanet, (lire en ligne)
- (pl) « Ministerstwo Zdrowia », Ministry of Health (Poland), (consulté le 12 juin 2021)
- (es) « Covid-19 Mexico », Instituciones del Gobierno de México (consulté le 12 juin 2021)
- (uk) « uk:За весь час пандемії в Україні », Ministry of Healthcare (Ukraine), (consulté le 12 juin 2021)
- « Coronavirus epidemic monitoring system », National Security and Defense Council of Ukraine (consulté le 12 juin 2021)
- (es) Ministry of Health (Peru), « Sala Situacional COVID-19 Perú »,
- (es) « Resultados de busqueda », sur gob.pe (consulté le 12 juin 2021)
- « Peta Sebaran » (consulté le 12 juin 2021)
- « COVID-19 Statistics in South Africa », sur sacoronavirus.co.za, (consulté le 11 juin 2021)
- « Department of Health », Department of Health (South Africa), (consulté le 11 juin 2021)
- (cs) « Aktuálně o koronaviru », Ministry of Health of the Czech Republic (consulté le 12 juin 2021)
- (nl) « Actuele informatie over het nieuwe coronavirus (COVID-19) », RIVM, (consulté le 11 juin 2021)
- « Statistieken over het Coronavirus en COVID-19 », sur allecijfers.nl (consulté le 11 juin 2021)
- (es) « Casos confirmados COVID-19 », Gobierno de Chile (consulté le 11 juin 2021)
- « Tracking every case of COVID-19 in Canada », CTV News, (consulté le 11 juin 2021)
- « Covid-19: Outbreak update », Government of Canada,
- « COVID-19 Case Bulletin », Department of Health (Philippines) (consulté le 12 juin 2021)
- « COVID-19 Tracker », Department of Health (Philippines) (consulté le 12 juin 2021)
- (ar) « ar:الموقف الوبائي اليومي لجائحة كورونا في العراق ليوم الخميس الموافق ٥ تشرين الثاني ٢٠٢٠ », Ministry of Health of Iraq, (consulté le 12 juin 2021)
- (ro) « Comunicate de presă », Ministry of Internal Affairs (Romania) (consulté le 12 juin 2021)
- (sv) « Antal fall av covid-19 i Sverige – data uppdateras 11:30 och siffrorna är tillgängliga 14:00 », sur Public Health Agency of Sweden – Official statistics at arcgis (consulté le 11 juin 2021) : « "Data updated daily at 11:30 [CEST]" »
- (nl) « COVID-19 – Epidemiologische situatie », sur Sciensano (consulté le 12 juin 2021)
- (nl) « Coronavirus COVID-19 » (consulté le 12 juin 2021)
- « COVID-19 Situation », sur covid.gov.pk, Government of Pakistan (consulté le 12 juin 2021)
- (pt) « Ponto de Situação Atual em Portugal », Direção-Geral da Saúde (consulté le 11 juin 2021)
- (pt) « Já se encontra disponível o relatório de situação de hoje », Direção-Geral da Saúde (consulté le 11 juin 2021)
- (he) « he:נגיף הקורונה בישראל – תמונת מצב כללית » (consulté le 11 juin 2021)
- « Tájékoztató oldal a koronavírusról », koronavirus.gov.hu, (consulté le 10 juin 2021)
- (bn) « bn:করোনা ভাইরাস ইনফো ২০১৯ », sur corona.gov.bd (consulté le 11 juin 2021)
- « কোভিড-১৯ ট্র্যাকার », sur covid19tracker.gov.bd (consulté le 11 juin 2021)
- (ja) « ja:新型コロナウイルス感染症の現在の状況と厚生労働省の対応について », Ministry of Health, Labour and Welfare (Japan), (consulté le 12 juin 2021)
- « COVID-19 Statistical report », Ministry of Health (Jordan), (consulté le 6 juin 2021)
- « Latest Information about COVID-19 in the Republic of Serbia », sur covid19.rs, Ministry of Health (Serbia) (consulté le 11 juin 2021)
- « Current situation in Switzerland », Federal Office of Public Health (consulté le 11 juin 2021)
- « Cas d'infection au Sars-CoV-2 en Suisse », Tribune de Genève (consulté le 24 décembre 2020)
- (de) « Bundesministerium für Inneres: Aktuelle Zahlen zum Corona-Virus », Innenministerium (consulté le 12 juin 2021)
- (ms) « Terkini Harian », Ministry of Health (Malaysia), (consulté le 12 juin 2021)
- « UAE Coronavirus (COVID-19) Updates », National Emergency Crisis and Disaster Management Authority (UAE), (consulté le 12 juin 2021)
- « COVID-19 Dashboard », Ministry of Health and Population (Nepal) (consulté le 12 juin 2021)
- (ar) « ar:الجمهورية اللبنانية – وزارة اﻹعلام – الموقع الرسمي لمتابعة أخبار فيروس الكورونا في لبنان », Ministry of Information (Lebanon), (consulté le 11 juin 2021)
- « Le Portail Officiel du Coronavirus au Marocco », Ministère de la santé (consulté le 11 juin 2021)
- (ar) « COVID 19 Dashboard: Saudi Arabia », Ministry of Health (Saudi Arabia), (consulté le 11 juin 2021)
- (es) « Las cifras del COVID-19 en Ecuador » (consulté le 11 juin 2021)
- (es) « Salud_Ec », Ministerio de Salud Pública, (consulté le 11 juin 2021)
- (bg) « bg:1 352 са новодиагностицираните с COVID-19 лица у нас през изминалото днонощие », Ministry of Health (Bulgaria), (consulté le 12 avril 2021)
- « COVID-19 in Bulgaria », sur coronavirus.bg, (consulté le 11 juin 2021)
- (el) « el:Δεδομένα για τον κορωνοϊό στην Ελλάδα - Τελευταία Ενημέρωση », Government of Greece, (consulté le 11 juin 2021)
- (ru) « За сутки в Беларуси зарегистрированы 1026 пациентов с COVID-19, выписаны 1187 », Belarusian Telegraph Agency, (lire en ligne)
- « Coronavirus (COVID-19) in the Slovak Republic in numbers », sur korona.gov.sk, National Health Information Center, (consulté le 12 juin 2021)
- (ru) « ru:Ситуация с коронавирусом официально », sur coronavirus2020.kz, Kazinform, (consulté le 11 juin 2021)
- (kk) « kk:Қазақстан Республикасы Денсаулық сақтау министрлігі », Ministry of Health (Kazakhstan) (consulté le 11 juin 2021)
- « Ministerio de Salud de Panamá », Ministry of Health (Panama), (consulté le 12 juin 2021)
- (es) « Datos Oficiales », sur Bolivia Segura, (consulté le 11 juin 2021)
- « Službena stranica Vlade », Croatian Institute of Public Health (consulté le 12 juin 2021)
- (es) « COVID-19 », Ministry of Public Health and Social Welfare (Paraguay), (consulté le 12 juin 2021)
- (ar) « The main figures », (consulté le 11 juin 2021)
- « StopCOV.ge » (consulté le 12 juin 2021)
- (az) « Azərbaycanda cari vəziyyət », sur koronavirusinfo.az, (consulté le 12 juin 2021)
- (es) « Situacion Nacional Covid-19 », Ministerio de Salud (Costa Rica), (consulté le 12 juin 2021)
- « COVID 19 Updates », Ministry of Health (Kuwait), (consulté le 12 juin 2021)
- (es) « Visualizador de casos coronavirus COVID-19 en Uruguay », Sistema Nacional de Emergencias (consulté le 12 juin 2021)
- (es) « Comunicados », Sistema Nacional de Emergencias (consulté le 12 juin 2021)
- « Homepage », Dominican Today, (consulté le 11 juin 2021)
- (da) « Tal og overvågning af COVID-19 », Sundhedsstyrelsen (Danish Health Authority), (consulté le 11 juin 2021)
- (da) « Statens Serum Institut – COVID-19 – Danmark », Statens Serum Institut (State Serum Institute) (consulté le 12 juin 2021)
- « Relevant information about Coronavirus (COVID-19) », Government of the Republic of Lithuania, (consulté le 12 juin 2021)
- (lt) « COVID-19 ligos apžvalga Lietuvoje », sur gislithuania.maps.arcgis.com (consulté le 12 juin 2021)
- (am) « Covid-19 », sur covid19.et, (consulté le 11 juin 2021)
- (ar) « ar:الصحة: ارتفاع حالات الشفاء من مصابي فيروس ... », Egyptian Ministry of Health and Population, (consulté le 12 juin 2021)
- « Latest updates on COVID-19 (Coronavirus) », Department of Health (Ireland),
- (ro) « COVID-19 în Republica Moldova: situaţia la zi », sur gismoldova.maps.arcgis.com (consulté le 12 juin 2021)
- (es) « Coronavirus », Ministerio de Salud Pública (Guatemala), (consulté le 11 juin 2021)
- (sl) « Statistični pregled koronavirusa v Sloveniji », sur www.rtvslo.si, (consulté le 11 juin 2021)
- « Coronavirus disease COVID-19 », Ministry of Health (Slovenia), (consulté le 21 mai 2021)
- (es) « Secretaría de Salud », Secretary of Health (Honduras), (consulté le 12 juin 2021)
- (es) « Coronavirus en Honduras », Secretaria de Salud de Honduras (consulté le 12 juin 2021)
- « Daily COVID-19 Report », Ministry of Health (Bahrain), (consulté le 11 juin 2021)
- (es) « Estadísticas Venezuela », MPPS COVID Patria, (consulté le 11 juin 2021)
- (hy) « hy:Հաստատված դեպքերն ըստ օրերի », NCDC Armenia, (consulté le 12 juin 2021)
- « Coronavirus Disease 2019 (COVID-19) », Ministry of Public Health (Qatar) (consulté le 11 juin 2021)
- « Covid-19 cases in Oman », Ministry of Health (Oman), (consulté le 11 juin 2021)
- « COVID-19 in Bosnia and Herzegovina », Ministry of Civil Affairs of Bosnia and Herzegovina, (consulté le 11 juin 2021)
- « COVID-19 : Live Situational Analysis Dashboard of Sri Lanka », Health Promotion Bureau (Sri Lanka), (consulté le 9 juin 2021)
- « Epidemiology Unit », Ministry of Health (Sri Lanka), (consulté le 12 juin 2021)
- (ar) « ar:البوابة الجغرافية لمراقبة انتشار فيروس كورونا في ليبيا », National Centre of Disease Control (Libya), (consulté le 10 juin 2021)
- « Ministry of Health », Ministry of Health (Kenya), (consulté le 11 juin 2021)
- « NCDC Covid-19 Page », Nigeria Centre for Disease Control, (consulté le 12 juin 2021)
- « COVID-19 Outbreak », Bangkok Post, (consulté le 27 mai 2021)
- (th) « th:ไทยรู้สู้โควิด », Ministry of Health (Thailand), (consulté le 3 mai 2021)
- (mk) « Real-time Coronavirus condition in North Macedonia », sur gdi.net (consulté le 10 juin 2021)
- « Coronavirus Disease 2019 (COVID-19) Surveillance Dashboard (Myanmar) », Ministry of Health and Sports (Myanmar), (consulté le 11 juin 2021)
- (es) « Nota informativa sobre la COVID-19 en Cuba », Ministerio de Salud (Cuba), (consulté le 11 juin 2021)
- (es) MINSAPCuba, « Coronavirus en Cuba », sur Twitter, (consulté le 11 juin 2021)
- « Coronavirus Disease-19, Republic of Korea », sur ncov.mohw.go.kr, Ministry of Health and Welfare (South Korea) (consulté le 12 juin 2021)
- « Press Release », sur kdca.go.kr, Korea Disease Control and Prevention Agency (consulté le 12 juin 2021)
- (lv) « Covid-19 izplatība Latvijā », sur covid19.gov.lv, (consulté le 12 juin 2021)
- (lv) « Covid-19 Statistika », sur www.spkc.gov.lv, Slimību Profilakses un Kontroles Centrs (Centre for Disease Prevention and Control), (consulté le 12 juin 2021)
- (sq) « Lajme Archives », Ministria e Shëndetësisë dhe Mbrojtjes Sociale (consulté le 11 juin 2021)
- (sq) « Coronavirus Albania Statistika », Agjencia Kombëtare e Shoqerisë së Informacionit (consulté le 11 juin 2021)
- « Information about Coronavirus disease COVID-19 », Estonian Health Board (consulté le 12 juin 2021)
- « Koroonaviiruse andmestik », Estonian Health Board (consulté le 12 juin 2021)
- « Coronavirus nombre de cas en Algérie », sur coronavirus-statistiques.com, (consulté le 10 juin 2021)
- Av Sondre Nilsen, Oda Leraan Skjetne, Yasmin Sfrintzeris, Hanna Haug Røset, Carina Hunshamar, Sofie Fraser et Ole Løkkevik, « Live: Corona-viruset sprer seg i Norge og verden », sur VG Nett (consulté le 12 juin 2021)
- (sq) « Covid-19 », sur Koha Ditore, (consulté le 11 juin 2021)
- (ru) « ru:Информации », Ministry of Health (Kyrgyz Republic), (consulté le 12 juin 2021)
- (ru) « ru:Коронавирусная инфекция (COVID-19) », sur coronavirus.uz, (consulté le 11 juin 2021)
- (cnr) « Statistički podaci o COVID/19 », sur covidodgovor.me, Government of Montenegro, (consulté le 11 juin 2021)
- ZMPublicHealth, « COVID19 update », sur Twitter,
- « COVID-19 Updates », Ghana Health Service, (consulté le 11 juin 2021)
- « Situation update on coronavirus [Finland's situation in brief] », Finnish Institute for Health and Welfare, (consulté le 9 juin 2021)
- « Varmistetut koronatapaukset Suomessa (COVID-19) », sur experience.arcgis.com, (consulté le 12 juin 2021)
- (zh-CN) « zh:截至6月11日24时新型冠状病毒肺炎疫情最新情况 », National Health Commission, (consulté le 11 juin 2021)
- « STATISTIQUES COVID-19 », sur covid19.minsante.cm, (consulté le 28 avril 2021)
- « Covid-19 dashboard », WHO (consulté le 8 juin 2021)
- (es) « SITUACIÓN NACIONAL », sur covid19.gob.sv, Ministry of Health (El Salvador), (consulté le 11 juin 2021)
- « COVID-19 Spread in Cyprus », sur covid19.ucy.ac.cy, (consulté le 6 juin 2021)
- « Afghanistan Covid-19 Cases », Ministry of Public Health (Afghanistan), (consulté le 12 juin 2021)
- (pt) « Início », sur covid19.ins.gov.mz, (consulté le 11 juin 2021)
- (pt) « Situação Epidemiológica COVID-19 República de Moçambique », Ministério da Saúde, (consulté le 11 juin 2021)
- « Coronavirus: COVID-19 », Government of Luxembourg, (consulté le 11 juin 2021)
- « COVID-19 Statistics Dashboard », Ministry of Health (Maldives), (consulté le 6 juin 2021)
- « COVID-19 Situation Report [Current Situation] », Ministry of Health (Singapore), (consulté le 9 juin 2021)
- « Mongolian COVID-19 Coronavirus Tracker », sur covid19mongolia.mn, Ministry of Health (Mongolia), (consulté le 11 juin 2021)
- « Summary of the national update », Ministry of Health and Social Services (Namibia), (consulté le 11 juin 2021)
- « COVID-19 Botswana Dashboard », sur covid19portal.gov.bw, Government of Botswana, (consulté le 10 juin 2021)
- « COVID-19 », Ministry of Health and Wellness (Jamaica), (consulté le 11 juin 2021)
- « COVID-19 Clinical Management Summary », Ministry of Health and Wellness (Jamaica), (consulté le 11 juin 2021)
- « COVID -19: point de la situation de la maladie à coronavirus du 30 avril 2021 », sante.gouv.ci, (consulté le 1er mai 2020)
- (en) « Ministère de la Santé et de l'Hygiène Publique », (consulté le 6 juin 2021)
- « MoH Uganda: COVID-19 Information Portal », sur covid19.gou.go.ug, Ministry of Health (Uganda), (consulté le 28 avril 2021)
- Ministry of Health- Uganda (@MinofHealthUG), « Covid-19 Daily Updates », sur Twitter, (consulté le 11 juin 2021)
- « Coronavirus : Riposte à l'épidémie : Tableau Récapitulatif des dons" », Ministry of Health and Social Action (Senegal), (consulté le 8 juin 2021)
- « Situation Covid-19 », Ministry of Public Health (Madagascar), (consulté le 9 juin 2021)
- « Madagascar: WHO Coronavirus Disease (COVID-19) Dashboard », sur covid19.who.int (consulté le 11 juin 2021)
- MoHCCZim, « COVID-19 update: As at 9 June 2021 », sur Twitter, (consulté le 11 juin 2021)
- (ar) « ar:التقرير الوبائي لكوفيد_19، ليوم الإثنين الموافق التقارير الوبائية لكوفيد_19، ليوم الخميس والجمعة والسبت ٥ يونيو. », (consulté le 9 juin 2021)
- (pt) « Últimos dados sobre o COVID-19 », COMISSÃO INTERMINISTERIAL DE ANGOLA - CISP, (consulté le 10 juin 2021)
- « Covid 19 National Information Dashboard », Ministry of Health and Population (Malawi), (consulté le 11 juin 2021)
- « Situation Épidémiologique en RDC », sur stopcoronavirusrdc.info, (consulté le 30 avril 2021)
- « Situation Épidémiologique Covid-19 En Republique Democratique du Congo au 10 Juin 2021 », CMR COVID-19, (consulté le 11 juin 2021)
- (km) « km:ចំនួនករណីឆ្លងជំងឺកូវីដសរុប », Ministry of Health (Cambodia), (consulté le 11 mai 2021)
- (km) « km:ក្រសួងសុខាភិបាលនៃព្រះរាជាណាចក្រកម្ពុជា », Ministry of Health of the Kingdom of Cambodia, (consulté le 11 juin 2021)
- « Official COVID-19 figures », Ministry of Health (Malta), (consulté le 12 juin 2021)
- (pt) « Situação Atual », sur covid19.cv, (consulté le 12 juin 2021)
- « Coronavirus (COVID-19) current situation and case numbers », Australian Government Department of Health, (consulté le 11 juin 2021)
- « Covid-19 Rwanda Cases », Rwanda Biomedical Centre (consulté le 10 juin 2021)
- Rwanda Ministry of Health (@RwandaHealth), « Amakuru Mashya Update », sur Twitter,
- « Syrian Arab Republic », Syrian Ministry of Health, (consulté le 10 juin 2021)
- « Situations Épidémiologique au Gabon », sur infocovid.ga, Comité de Pilotage du Plan de Veille, (consulté le 12 juin 2021)
- « Trinidad and Tobago COVID-19 (Novel Coronavirus) UPDATE#740 », sur health.gov.tt (consulté le 30 mai 2021)
- « Ministry of Health, Trinidad & Tobago: COVID-19 Tracker », sur experience.arcgis.com (consulté le 12 juin 2021)
- « Situation du coronavirus en Guinée », Agence Nationale de Sécurité Sanitaire, (consulté le 11 juin 2021)
- « Mauritania COVID-19 Situation Report 2021-04-18AR », Ministère de la Santé Mauritania,
- (ar) « ar:حالة اليوم », Ministère de la Santé du Mauritania,
- EswatiniGovern1, « COVID-19 Update », sur Twitter, (consulté le 11 juin 2021)
- « Home », Ministry of Health (Guyana) (consulté le 11 juin 2021)
- « Covid-19 In PNG Statistics », sur covid19.info.gov.pg, Joint Agency Task Force National Control Centre for COVID-19, Government of Papua New Guinea, (consulté le 11 juin 2021)
- (nl) « COVID-19 », sur COVID SURINAME (consulté le 12 juin 2021)
- « COVID-19 Dashboard, Somalia », Ministry of Health (Somalia), (consulté le 8 juin 2021)
- « COVID-19 : Situation en Haiti », Ministère de la Santé Publique et de la Population du Republique d'Haiti (consulté le 9 juin 2021)
- « Du Ministere de la sante et du développement social sur le suivi des actions de prevention et de riposte face a la maladie a coronavirus », sur sante.gov.ml, (consulté le 6 juin 2021)
- (ca) « Coronavirus updates », sur www.govern.ad, Govern d'Andorra, (consulté le 12 juin 2021)
- (ru) « COVID-19: Шабонарӯзи охир дар Тоҷикистон ягон ҳолати нави гирифторшавӣ ба ин беморӣ ба қайд гирифта нашуд » (consulté le 18 mars 2021)
- « Tajikistan: WHO Coronavirus Disease (COVID-19) Dashboard », sur covid19.who.int (consulté le 1er mai 2021)
- « Situation au Togo », sur covid19.gouv.tg, Government of Togo, (consulté le 12 juin 2021)
- « Service d'Information du Gouvernement – Burkina Faso », (consulté le 6 juin 2021)
- « Maladie à coronavirus : 00 nouveaux cas confirmés, 08 guérisons et 00 décès à la date du 02 mai 2021 », Service d'Information du Gouvernement du Burkina Faso (consulté le 5 mai 2021)
- « Belize COVID-19 Cumulative Report SARSCoV2 Lab Screenings », (consulté le 11 juin 2021)
- « Coronavirus Disease (COVID-19) in HK », Hong Kong, Department of Health, (consulté le 10 juin 2021)
- « COVID-19 Report Update #433 », Ministry of Health (Bahamas) (consulté le 4 juin 2021)
- (en) « WHO daily Report », sur www.who.int (consulté le 4 juin 2021)
- « Ministere de la Sante, de la Population, de la Promotion de la Femme et de l'integration de la Femme au Developpement », sur www.sante.gouv.cg (consulté le 31 octobre 2020)
- « COVID-19 Local Situation », Ministry of Health (Seychelles), (consulté le 27 mai 2021)
- « COVID-19 in Seychelles », Ministry of Health (Seychelles), (consulté le 11 juin 2021)
- « Communique De Presse COVID-19 », (consulté le 6 juin 2021)
- nacosec, « Lesotho COVID-19 Statistics », sur Twitter,
- « Update on COVID-19 Response », Ministry of Health Republic of South Sudan, (consulté le 27 mai 2021)
- (es) « Covid 19 de Guinea Ecuatorial », Guinea Ecuatorial Salud, (consulté le 11 juin 2021)
- « COVID-19 全球即時疫情地圖 », (consulté le 12 juin 2021)
- « Coronavirus (Covid-19) », Gouvernement de la République du Bénin, (consulté le 11 juin 2021)
- (es) « Estadísticas de COVID-19 en Nicaragua », Observatorio Ciudadano, (consulté le 12 juin 2021)
- (vi) « Trang Tin Về Dịch Bệnh Viêm Đường Hô Hấp Cấp Covid-19 », Ministry of Health (Vietnam), (consulté le 12 juin 2021)
- (en) « WHO daily Report », sur www.who.int (consulté le 8 juin 2021)
- Ministère de la Santé et de la Population (@MSPCentrafrique), « Communiqué de Presse », sur Twitter,
- « [Current Situation] COVID-19 cases in Timor-Leste », COVID-19 Timor-Leste Dashboard, (consulté le 8 juin 2021)
- (ar) YSNECCOVID19, « ar:آخر إحصائيات انتشار فيروس #كورونا في #اليمن#معا_لمواجهة_كورونا », sur Twitter (consulté le 11 juin 2021) Missing or empty |date= (help)
- (is) « COVID-19 á Íslandi – Tölfræði », sur www.covid.is (consulté le 11 juin 2021)
- « The Gambia COVID-19 Outbreak Situational Report », Ministry of Health (The Gambia), (consulté le 8 juin 2021)
- « Press release from the Minister of Public Health », Niger Ministry of Public Health, (consulté le 1er mai 2021)
- « Communiqué du 05/06/2021 », (consulté le 6 juin 2021)
- « Aggiornamento settimanale epidemia COVID-19 e andamento Campagna Vaccinale al 31 maggio 2021 », Istituto per la Sicurezza Sociale di San Marino (consulté le 31 mai 2021)
- « Saint Lucia's COVID-19 Dashboard [Statistics] », Ministry of Health and Wellness (Saint Lucia), (consulté le 12 juin 2021)
- « WHO daily Report », sur www.who.int (consulté le 20 avril 2021)
- « Communiqué N* 415 de la Coordination Nationale de Riposte Sanitaire », Ministère de la Santé Publique du Tchad, (consulté le 6 juin 2021)
- (en) « Burundi: WHO Coronavirus Disease (COVID-19) Dashboard », sur covid19.who.int (consulté le 12 juin 2021)
- « The Ministry of Information and Communication – Sierra Leone » (consulté le 11 juin 2021)
- « Announcement from the Ministry of Health », Eritrea Ministry Of Information (consulté le 11 juin 2021)
- Coordination Comores Contre COVID-19, « Pandémie COVID -19/ Union des Comores Communiqué N°254 »,
- (pt) « Dashboard Bissau Covid », sur Dados Bissau (consulté le 11 juin 2021)
- « Boletim Epidemiológico Semanal de 19 a 25 de Abril de 2021 Nr.34 », sur Alto Comissariado para a Covid-19 (consulté le 27 avril 2021)
- (de) « Ministerium für Gesellschaft », (consulté le 12 juin 2021)
- « Covid-19 : quatre nouveaux cas positifs ce vendredi 11 juin », Government of the Principality of Monaco, (consulté le 12 juin 2021)
- (pt) « Situação Actual em São Tomé e Príncipe », sur covid.ms.gov.st, Ministério da Saúde (São Tomé e Príncipe), (consulté le 12 juin 2021)
- « COVID-19 – Latest updates », sur covid19.govt.nz, Government of New Zealand, (consulté le 5 mai 2021)
- « COVID-19 – current cases », Ministry of Health (New Zealand), (consulté le 11 juin 2021)
- « Liberia COVID-19 Daily Case Update By County », (consulté le 11 juin 2021)
- (lo) « ຄະນະສະເພາະກິດເພື່ອປ້ອງກັນ, ຄວບຄຸມ ແລະ ແກ້ໄຂການລະບາດ: ຂອງພະຍາດອັກເສບປອດ ຈາກເຊື້ອຈຸລະໂລກສາຍພັນໃຫມ່ (COVID-19) », sur covid19.gov.la, Laos Coronavirus Task Force, (consulté le 12 juin 2021)
- « COVID-19 In Bhutan », Government of Bhutan (consulté le 11 juin 2021)
- « COVID-19 Updates & News in Mauritius », sur covid19mu.com, Ministry of Health and Wellness (Mauritius), (consulté le 11 juin 2021)
- « Home », sur COVID19.gov.ag, Government of Antigua and Barbuda, (consulté le 10 juin 2021)
- (ja) « ja:国内感染者1万6395人 死者773人(クルーズ船除く)新型コロナ », sur nhk.or.jp,
- « How lax rules, missed warnings led to Japan's second coronavirus cruise-ship hot spot », sur Reuters, (consulté le 9 mai 2020)
- « Covid-19: Tanzania updates will resume after improvements at national laboratory », THECITIZEN (consulté le 8 mai 2020)
- « Zanzibar confirms 29 new cases, plus 11 recoveries », ippmedia.com (consulté le 8 mai 2020)
- « COVID-19 Updates », Ministry of Health and Medical Services, (consulté le 11 juin 2021)
- « One new import case COVID-19 reported today, 07 May 2021 » [PDF], Ministry of Health (Brunei), (consulté le 7 mai 2021)
- « Latest News », Ministry of Health (Brunei) (consulté le 11 juin 2021)
- (en) « COVID-19 Update: One New Case », sur Governemental Information Service (consulté le 30 octobre 2020).
- « Dominica Coronavirus Update », Ministry of Health, Wellness and New Health Investment Response to COVID-19 (Commonwealth of Dominica), (consulté le 11 juin 2021)
- « COVID-19 Update COVID-19 Grenada Dashboard », Ministry of Health (Grenada), (consulté le 28 avril 2021)
- « Four New COVID-19 Cases From Canada And The UK », sur The official website of the Government of Saint Vincent and the Grenadines, The Government of Saint Vincent and the Grenadines, (consulté le 14 décembre 2020)
- « COVID-19 Report As At December 1st, 2020 », sur National Emergency Management Organisation (NEMO), (consulté le 2 décembre 2020)
- « Government of St. Kitts and Nevis – COVID – 19 Updates » (consulté le 10 juin 2021)
- « St.Kitts-Nevis COVID-19 Situation Report No. 427 », Government of St. Kitts and Nevis, (consulté le 2 juin 2021)
- « Special webpage against Epidemics », sur www.ssm.gov.mo, (consulté le 9 juin 2021)
- « Dichiarazione del Direttore della Sala Stampa della Santa Sede, Matteo Bruni, 06.06.2020 », sur Official The Holy See website (consulté le 7 juin 2020)
- « Vaticano, nuovo caso di positività al Covid-19 », sur vaticannews.va (consulté le 17 octobre 2020)
- « Le ministère de la Santé publique confirme qu'il continue de respecter les mesures préventives », sur Sahara Press Service (consulté le 25 septembre 2020).
- « services médicaux du ministère de la santé ».
- « Deal is done: Cruise ship with sick passengers and sister ship will be allowed to dock in Florida », NBC News (consulté le 2 avril 2020)
- « Indonesian crew member of virus-hit Zaandam cruise ship dies in Florida », sur South China Morning Post, (consulté le 11 avril 2020)
- « Coronavirus: les îles Marshall isolées enregistrent les premiers cas ».
- « Samoa records first positive Covid test result », (consulté le 7 décembre 2020)
- « Samoa: WHO Coronavirus Disease (COVID-19) Dashboard », sur covid19.who.int (consulté le 1er juin 2021)
- « Vanuatu Ministry of Health Covid-19 Updates », sur Vanuatu Ministry of Health COVID-19 Updates, (consulté le 22 mai 2021)
- « Vanuatu Situation Report #38 – 3 June 2021 », sur Vanuatu Ministry of Health COVID-19 Updates, (consulté le 5 juin 2021)
- (en) « Micronesia: COVID-19 », FICR, (lire en ligne)
- « S'informer sur le Coronavirus », sur popsciences.universite-lyon (consulté le 1er avril 2020).
- Zhu N., Zhang D., Wang W. et al., « A Novel Coronavirus from Patients with Pneumonia in China, 2019. », The New England Journal of Medicine, vol. 382, no 8, , p. 727-733 (PMID 31978945, PMCID PMC7092803, DOI 10.1056/NEJMoa2001017).
- Jacobson E.R (2007) Infectious Diseases and Pathology of Reptiles; CRC Press, Taylor & Francis Group: Boca Raton, FL, États-Unis ; p. 33487–2742 (lien Google Livre)
- (en) K. Yagami, K. Hirai et N. Hirano, « Pathogenesis of haemagglutinating encephalomyelitis virus (HEV) in mice experimentally infected by different routes », Journal of Comparative Pathology, vol. 96, no 6, , p. 645–657 (PMID 3546411, PMCID PMC7130377, DOI 10.1016/0021-9975(86)90061-7, lire en ligne, consulté le 17 mai 2020)
- (en) Susan J. Bender et Susan R. Weiss, « Pathogenesis of Murine Coronavirus in the Central Nervous System », Journal of Neuroimmune Pharmacology, vol. 5, no 3, , p. 336–354 (ISSN 1557-1890 et 1557-1904, PMID 20369302, PMCID PMC2914825, DOI 10.1007/s11481-010-9202-2, lire en ligne, consulté le 17 mai 2020)
- (en) Timothy J Cowley et Susan R Weiss, « Murine coronavirus neuropathogenesis: determinants of virulence », Journal of NeuroVirology, vol. 16, no 6, , p. 427–434 (ISSN 1355-0284 et 1538-2443, DOI 10.1007/BF03210848, lire en ligne, consulté le 17 mai 2020)
- Lane, Thomas E et Martin P Hosking. 2010. « The pathogenesis of murine coronavirus infection of the central nervous system. » Critical reviews in immunology 30 (2): 119‐30.
- https://www.humanite.fr/bruno-canard-le-chercheur-qui-avait-alerte-en-2015-sur-le-risque-de-coronavirus-denonce-le-686372
- (en) Fang Li, Wenhui Li, Michael Farzan et Stephen C. Harrison, « Structure of SARS Coronavirus Spike Receptor-Binding Domain Complexed with Receptor », Science, vol. 309, no 5742, , p. 1864-1868 (PMID 16166518, DOI 10.1126/science.1116480, JSTOR 3843779, Bibcode 2005Sci...309.1864L, lire en ligne, consulté le 25 janvier 2020)
- (en) Thomas C. Holland, Neurovirology in Handbook of Clinical Neurology, 2014 lire en ligne
- (en) Fehr, Anthony R, Stanley Perlman. “Coronaviruses: an overview of their replication and pathogenesis.” Methods in molecular biology (Clifton, N.J.) vol. 1282 (2015): 1-23. doi:10.1007/978-1-4939-2438-7_1 lire en ligne
- Cascella M, Rajnik M, Cuomo A, et al. Features, Evaluation and Treatment Coronavirus (COVID-19), in: StatPearls [Internet], StatPearls Publishing, Treasure Island (Floride), janvier 2020, mis à jour le 8 mars 2020 lire en ligne
- (en) Shuo Su et Gary Wong, « Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses », sur Trends in Microbiology, (DOI 10.1016/j.tim.2016.03.003, consulté le 23 mai 2020), p. 490–502
- (en) Lok-Yin Roy Wong et Pak-Yin Lui, « A molecular arms race between host innate antiviral response and emerging human coronaviruses », sur Virologica Sinica, (ISSN 1674-0769, PMID 26786772, PMCID PMC7090626, DOI 10.1007/s12250-015-3683-3, consulté le 23 mai 2020), p. 12–23
- (en) Shuo Su et Gary Wong, « Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses », sur Trends in Microbiology, (PMID 27012512, PMCID PMC7125511, DOI 10.1016/j.tim.2016.03.003, consulté le 23 mai 2020), p. 490–502
- (en) Ping-Kun Hsieh, Shin C. Chang, Chu-Chun Huang et Ting-Ting Lee, « Assembly of severe acute respiratory syndrome coronavirus RNA packaging signal into virus-like particles is nucleocapsid dependent », Journal of Virology, vol. 79, no 22, , p. 13848–13855 (ISSN 0022-538X, PMID 16254320, PMCID 1280188, DOI 10.1128/JVI.79.22.13848-13855.2005, lire en ligne, consulté le 13 mars 2020).
- (en) CDC, « Human Coronavirus Types », sur Center for Disease Control Prevention (consulté le 22 janvier 2020).
- (en) Liu P, Shi L, Zhang W, He J, Liu C, Zhao C, Kong SK, Loo JF, Gu D, Hu L, « Prevalence and genetic diversity analysis of human coronaviruses among cross-border children », Virology Journal, vol. 14, no 1, , p. 230 (PMID 29166910, PMCID 5700739, DOI 10.1186/s12985-017-0896-0).
- Fehr AR, Perlman S, « Coronaviruses: an overview of their replication and pathogenesis », Methods in Molecular Biology, vol. 1282, , p. 1–23 (ISBN 978-1-4939-2437-0, PMID 25720466, PMCID 4369385, DOI 10.1007/978-1-4939-2438-7_1).
- L'hypothèse du pangolin javanais comme hôte intermédiaire du coronavirus
- Coronavirus Disease (COVID-19 cdc.gov, consulté le 02 mars 2020.
- « MERS-CoV », Institut Pasteur, (consulté le 29 janvier 2020).
- (en-US) CDC, « Middle East Respiratory Syndrome (MERS) », sur Centers for Disease Control and Prevention, (consulté le 29 janvier 2020).
- « SRAS », Institut Pasteur, (consulté le 29 janvier 2020).
- O.M.S, « Syndrome aiguë respiratoire », sur O.M.S (consulté le 29 janvier 2020).
- (en-US) « SARS | Home | Severe Acute Respiratory Syndrome | SARS-CoV Disease | CDC », sur www.cdc.gov, (consulté le 29 janvier 2020).
- Vincent J. Munster, Marion Koopmans, Neeltje van Doremalen et Debby van Riel, « A Novel Coronavirus Emerging in China — Key Questions for Impact Assessment », The New England Journal of Medicine, vol. 382, no 8, , p. 692–694 (ISSN 0028-4793, DOI 10.1056/NEJMp2000929, lire en ligne, consulté le 3 mars 2020).
- Organisation mondiale de la santé, "Consensus document on the epidemiology of severe acute respiratory syndrome (SARS)", 2003, page 15.
- (en) Huijun Chen, Juanjuan Guo, Chen Wang et Fan Luo, « Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records », The Lancet, vol. 395, no 10226, , p. 809–815 (ISSN 0140-6736 et 1474-547X, PMID 32151335, DOI 10.1016/S0140-6736(20)30360-3, lire en ligne, consulté le 27 mars 2020).
- Corwin A. Robertson, Sara A. Lowther, Thomas Birch et Christina Tan, « SARS and Pregnancy: A Case Report », Emerging Infectious Diseases, vol. 10, no 2, , p. 345–348 (ISSN 1080-6040 et 1080-6059, PMID 15030710, PMCID PMC3322896, DOI 10.3201/eid1002.030736, lire en ligne, consulté le 15 avril 2020)
- (en) Kimberly A. Lackey, Ryan M. Pace, Janet E. Williams et Lars Bode, « SARS-CoV-2 and human milk: what is the evidence? », medRxiv, , p. 2020.04.07.20056812 (DOI 10.1101/2020.04.07.20056812, lire en ligne, consulté le 15 avril 2020)
- Étude du Johns Hopkins Bloomberg School of Public Health, de Baltimore associée à School of Public Health and Health Sciences du Massachusetts, et à la Ludwig-Maximilians-Universität de Munich.
- (en) David L. Swerdlow et Lyn Finelli, « Preparation for Possible Sustained Transmission of 2019 Novel Coronavirus: Lessons From Previous Epidemics », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.1960, lire en ligne, consulté le 12 février 2020).
- « Le taux de reproduction de COVID-19 est plus élevé que celui du SRAS ».
- https://www.lemonde.fr/les-decodeurs/article/2020/02/06/coronavirus-une-affiche-du-ministere-ecarte-trop-vite-le-risque-de-contagion-lors-de-l-incubation_6028658_4355770.html
- (en) Smriti Mallapaty, « What the cruise-ship outbreaks reveal about COVID-19 », Nature, , d41586–020–00885-w (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-00885-w, lire en ligne, consulté le 27 mars 2020).
- « Coronavirus : la maladie pourrait aussi se transmettre par voie fécale », sur www.pourquoidocteur.fr (consulté le 17 mars 2020).
- « Coronavirus : L’OMS indique que le taux de mortalité est de 3,4 % », Intellivoire, (lire en ligne, consulté le 5 mars 2020).
- (en) Jie Cui, Fang Li et Zheng-Li Shi, « Origin and evolution of pathogenic coronaviruses », Nature Reviews Microbiology, vol. 17, no 3, , p. 181–192 (ISSN 1740-1534, DOI 10.1038/s41579-018-0118-9, lire en ligne, consulté le 17 mars 2020).
- Coronavirus disease (COVID-19) advice for the public, OMS, 2020.
- « Coronavirus – informations et conseils », sur Centre de vaccinations internationales Air France (consulté le 13 mars 2020).
- Stockman LJ, Bellamy R, Garner P. SARS: systematic review of treatment effects. PLoS Med. 2006;3:e343. doi:10.1371/journal.pmed.0030343
- https://universiteouverte.org/2020/03/04/coronavirus-la-science-ne-marche-pas-dans-lurgence/
- Zhu, M. 2004. SARS immunity and vaccination. Cell. Mol. Immunol. 1:193-198
- https://sciences-critiques.fr/bruno-canard-demander-un-medicament-des-le-lendemain-dune-epidemie-na-aucun-sens/
- coronavirus Study Group ou CSG
- Gorbalenya A.E & a. (2020) Severe acute respiratory syndrome-related coronavirus: The species and its viruses – a statement of the Coronavirus Study Group. bioRxiv, https://www.biorxiv. org/content/10.1101/2020.02.07.937862v1.full.pdf.
- de Groot RJ, Baker SC, Baric R, Enjuanes L, Gorbalenya AE, Holmes KV, Perlman S, Poon L, Rottier PJ, Talbot PJ, Woo PC, Ziebuhr J, Ninth Report of the International Committee on Taxonomy of Viruses, Oxford, Elsevier, , 806–828 p. (ISBN 978-0-12-384684-6), « Family Coronaviridae ».
- International Committee on Taxonomy of Viruses, « ICTV Master Species List 2009 – v10 » [xls], .
- Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, [...] Tan W, 2020. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. The Lancet doi: https://doi.org/10.1016/S0140-6736(20)30251-8.
- (en) Kerstin Erles, Kai-Biu Shiu et Joe Brownlie, « Isolation and sequence analysis of canine respiratory coronavirus », Virus Research, vol. 124, no 1, , p. 78–87 (ISSN 0168-1702, DOI 10.1016/j.virusres.2006.10.004, lire en ligne, consulté le 17 mars 2020).
- (en) Kerstin Erles, Crista Toomey, Harriet W Brooks et Joe Brownlie, « Detection of a group 2 coronavirus in dogs with canine infectious respiratory disease », Virology, vol. 310, no 2, , p. 216–223 (ISSN 0042-6822, DOI 10.1016/S0042-6822(03)00160-0, lire en ligne, consulté le 17 mars 2020).
- (en) « Virus taxonomy: 2018b release », sur ICTV online, (consulté le 24 janvier 2020).
Voir aussi
Bibliographie
- (en) Christine V.F. Carrington, Jerome E. Foster, Hua Chen Zhu, Jin Xia Zhang, Gavin J.D. Smith, Nadin Thompson, Albert J. Auguste, Vernie Ramkissoon, Abiodun A. Adesiyun et Yi Guan, « Detection and Phylogenetic Analysis of Group 1 Coronaviruses in South American Bats », Emerging Infectious Diseases journal, Centers for Disease Control and Prevention, vol. 14, no 12, , p. 1890-1893 (DOI 10.3201/eid1412.080642, lire en ligne)
- Habibzadeh P, Stoneman EK "The Novel Coronavirus: A Bird's Eye View". The International Journal of Occupational and Environmental Medicine. 11 (2): 65–71. doi:10.15171/ijoem.2020.1921. (résumé).
- Saif, L. J., Wang, Q., Vlasova, A. N., Jung, K., & Xiao, S. (2019). Coronaviruses. Diseases of swine, 488-523.
- Nathalie Kin et Astrid Vabret, « Les infections à coronavirus humains », sur Revue Francophone des Laboratoires, (PMID 32288826, PMCID PMC7140280, DOI 10.1016/S1773-035X(16)30369-0, consulté le 22 mai 2020), p. 25–33
Infographie
- Frédérique Schneider, « Coronavirus, les chiffres de l’épidémie », sur La Croix, (consulté le 18 février 2020)
Articles connexes
- Coronavirus du syndrome respiratoire du Moyen-Orient (MERS-CoV pour Middle East respiratory syndrome coronavirus, anciennement NCoV)
- Virologie
- Coronavirus félin
- Péritonite infectieuse féline
- Maladie à coronavirus 2019
- Syndrome respiratoire aigu sévère
- Pneumonie aiguë
- Urgence de santé publique de portée internationale (USPPI)
- Sociétés biopharmaceutiques en développement sur un vaccin : Moderna Therapeutics, CureVac, etc.
- Pandémie de Covid-19
Liens externes
- (en) CDC, CDC Novel Coronavirus et CDC’s case definitions and guidance.
- (en) CDC, Site internet (CDC) consacré au novel coronavirus.
- (en) OMS, WHO Novel Coronavirus Infection—UpdateExternal.
- (en) Health Protection Agency Novel Coronavirus 2012.
- (fr) Cartes situation générale [1].
- (en) ECDC, ECDC: Novel Coronavirus update to Rapid Risk AssessmentExternal.
- (en) CDC Mise à jour : Severe Respiratory Illness Associated with a Novel Coronavirus—Worldwide, 2012–2013 MMWR March 7, 2013/62 (Early Release), p. 1-2.
- (en) CDC Severe Respiratory Illness Associated with a Novel Coronavirus — Saudi Arabia and Qatar, 2012 MMWR October 12, 2012/61, p. 820-820.
- Thankyoucaretakers.com/fr, initiative mise en place lors de la pandémie de COVID-19 de 2019/2020 et ayant pour objectif de rassembler 1 million de messages de remerciements pour les soignants du monde.
Information
Article Coronavirus en français Wikipedia a pris les places suivantes dans le classement local de popularité:
- 3 place au 2020-03-01
- 2 place au 2020-03-02
- 2 place au 2020-03-03
- 2 place au 2020-03-04
- 2 place au 2020-03-05
- 3 place au 2020-03-06
- 4 place au 2020-03-07
- 8 place au 2020-03-08
- 6 place au 2020-03-09
- 3 place au 2020-03-10
- 4 place au 2020-03-11
- 4 place au 2020-03-12
- 4 place au 2020-03-13
- 4 place au 2020-03-14
- 3 place au 2020-03-15
- 3 place au 2020-03-16
- 3 place au 2020-03-17
- 2 place au 2020-03-18
- 4 place au 2020-03-19
- 4 place au 2020-03-20
- 7 place au 2020-03-21
- 16 place au 2020-03-22
- 11 place au 2020-03-23
- 11 place au 2020-03-24
- 9 place au 2020-03-25
- 10 place au 2020-03-26
- 9 place au 2020-03-27
- 11 place au 2020-03-28
- 15 place au 2020-03-29
- 11 place au 2020-03-30
- 15 place au 2020-03-31
À propos de la page
Le contenu présenté de l'article Wikipédia a été extrait en 2021-06-12 sur la base de https://fr.wikipedia.org/?curid=877492